
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£� 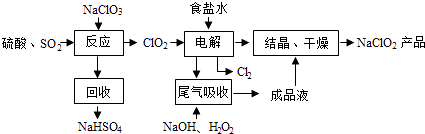
�ش��������⣺
��1��NaClO2��Cl�Ļ��ϼ�Ϊ ��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ ��
��3������⡱����ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2+��Ca2+ �� Ҫ������Լ��ֱ�Ϊ�� �� ����⡱��������Ӧ����Ҫ������ ��
��4����β�����ա������ա���⡱�����ų�������ClO2 �� �����շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ �� �÷�Ӧ������������ ��
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ �� ��������������λС����
���𰸡�
��1��+3��
��2��2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2
��3��NaOH��Һ��Na2CO3��Һ��ClO2������NaClO2��
��4��2��1��O2
��5��1.57
���������⣺��1.����NaClO2��NaΪ+1�ۣ�OΪ��2�ۣ������������ϼ۵Ĵ�����Ϊ0���ɵ�Cl�Ļ��ϼ�Ϊ+3�ۣ����Դ��ǣ�+3��
��2.��NaClO3��SO2��H2SO4�ữ����������ClO2 �� ����NaClO2������������ԭ����ΪNaCl�����ղ���ΪNaHSO4 �� ˵�������������ƣ��Ҳ���ClO2 �� ���ݵ����غ��֪���˷�Ӧ�Ļ�ѧ����ʽΪ��2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2 �� ���Դ��ǣ�2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2��
��3.��ʳ����Һ�л���Mg2+ ��Ca2+ �� �������ù���NaOH��Һ��ȥMg2+ �� ���ù���Na2CO3��Һ��ȥCa2+ �� ClO2��������ǿ�����ݽᾧ�����IJ����֪ClO2�Ļ�ԭ����ΪNaClO2 �� ��˵��װ��������ClO2�õ�������ClO2�� �� ����Cl��ʧ��������Cl2 �� ���Դ��ǣ�NaOH��Һ��Na2CO3��Һ��ClO2������NaClO2����
��4.������ͼʾ��֪�����ú��������������������Һ����ClO2 �� ����ΪClO2�� �� ��˷�Ӧ��ClO2Ϊ����������ԭ����ΪClO2�� �� ���ϼ۴�+4�۽�Ϊ+3�ۣ�H2O2Ϊ��ԭ������������ΪO2 �� ÿĦ��H2O2�õ�2mol���ӣ����ݵ����غ��֪�������ͻ�ԭ�������ʵ���֮��Ϊ2��1�����Դ��ǣ�2��1��O2��
��5.��1gNaClO2�����ʵ��� ![]() =
= ![]() mol�����ݵ���ת����Ŀ��ȣ�NaClO2��Cl����4e�� �� Cl2��2Cl����2e�� �� ��֪���������ʵ���Ϊ
mol�����ݵ���ת����Ŀ��ȣ�NaClO2��Cl����4e�� �� Cl2��2Cl����2e�� �� ��֪���������ʵ���Ϊ ![]() mol��4��
mol��4�� ![]() =
= ![]() mol��������������Ϊ
mol��������������Ϊ ![]() mol��71g/mol=1.57g�����Դ��ǣ�1.57g��
mol��71g/mol=1.57g�����Դ��ǣ�1.57g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2KMnO4��16HCl===2KCl��2MnCl2��5Cl2����8H2O��Ӧ��(����)
A. �������뻹ԭ�������ʵ���֮��Ϊ1��8
B. �������뻹ԭ�������ʵ���֮��Ϊ5��1
C. ���������뻹ԭ��������ʵ���֮��Ϊ5��2
D. ���������뻹ԭ��������ʵ���֮��Ϊ2��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˵����С��18��ijԪ��X����ԭ�Ӻ�����Ӳ���Ϊa������������Ϊ��2a+l)�������й�Ԫ��X��˵���У�����ȷ���ǣ���
A. Ԫ��X��ԭ�Ӻ�������������Ϊ��2a2-l��
B. Ԫ��X�γɵĵ��ʼ�������������������ԭ��
C. Ԫ��X�γɵļ����ӣ������Ӳ�ĵ��������ﵽ2n2����n��ʾ���Ӳ�����
D. ��Ԫ��X�γɵ�ijЩ��������ܾ���ɱ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϸ����Ĥ����ѧԪ�����ٰ�����
A��C��H��O��N
B��C��H��O��N��P
C��C��H��O��S��P
D��C��H��O��Mg��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����7.28g Fe���ڹ�����ϡH2SO4�У��ڼ��ȵ������£���2.02gKNO3ȥ������Һ��Fe2+ �� ����Ӧ��ȫ��ʣ��Fe2+����0.4mol/L KMnO4��Һ25mL������ȫ��������KNO3�Ļ�ԭ��� ��
A.NO
B.NO2
C.N2O
D.N2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ����Ũ��Ϊ0.100 0 mol��L��1��NaOH��Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.100 0 mol��L��1��HX��HY��Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ������˵����ȷ����( )

A. ��V(NaOH)��0 mLʱ��c(X��)>c(Y��)
B. a��ʱ��c(Y��)��c(HY)��0.100 0 mol��L��1
C. b��ʱ��c(HX)>c(Na��)>c(X��)>c(OH��)>c(H��)
D. ��V(NaOH)��20.00 mLʱ��NaX��NaY����Һ�е�������������Դ�С��Nǰ��>N����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��ʵ�飬����ʵ������Ԥ�ڼ���Ӧ���۾���ȷ���ǣ� ��
a | b | ʵ������Ԥ�� | ���� | |
A | ͭ˿ | Ũ���� | �Թ�c���д�������ɫ���� | ������ǿ������ |
B | ľ�� | 18.4mol/L���� | ľ����� | Ũ���������Լ������� |
C | ���� | NaCl��Һ | ���ܴ��������� | ��������������ʴ |
D | ��˿ | ������HCl��H2O2��Һ | �Թ�c���д�����ɫ���� | �÷�Ӧ���������� |

A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˻�������ЧӦ����ѧ������˶��ֻ��պ�����CO2�ķ�����
����I:����FeO����CO2���H2
��.6FeO(s)+CO2(g)=--2Fe3O4(s)+C(s) ��H1=-76.0kJ/mol
��.C(s)+2H2O(g)=CO2(g)+2H2(g) ��H2=+113.4kJ/mol
��1��3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ��H3=________��
��2���ڷ�Ӧi��,ÿ�ų�38.0kJ��������_______gFeO��������
����II:����CO2�Ʊ�CH4
300��ʱ����2L�����ܱ������г���2molCO2��8molH2��������Ӧ��CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ��H4�����������CH4��Ũ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��
CH4(g)+2H2O(g) ��H4�����������CH4��Ũ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��
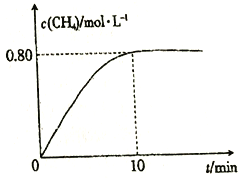
��3�� ���ӷ�Ӧ��ʼ��ǡ�ôﵽƽ��ʱ��H2��ƽ����Ӧ����v(H2)=_________��
��300��ʱ����Ӧ��ƽ�ⳣ��K=____________��
�������¶Ȳ��䣬��ƽ�����������ٳ���2molCO2��8molH2�����´ﵽƽ��ʱCH4��Ũ��_________(����ĸ)��
A.����0.8mol/L B.����1.6 mol/L C.0.8 mol/L <c(CH4)<1.6 mol/L D.����1.6 mol/L
��4��300��ʱ���������������1.6molCO2��2.0molH2��5.6molCH4��4.0molH2O(g)����v��____v��(����>����<������=��)��
��5����֪:200��ʱ���÷�Ӧ��ƽ�ⳣ��K=64.8L2��mol-2������H4______0(����>����<������=��)��
������:�ü���Һ����CO2
����100mL3mol/LNaOH��Һ����4.48LCO2(��״��)���õ�����Һ��
��6��������Һ������Ũ�ȵĴ�С����Ϊ______________����������Һ���ɡ����������أ����ù���ijɷ���__________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��As2O3��ҽҩ�����ӵ���������ҪӦ�á�ij����Ԫ�أ�As���Ĺ�ҵ��ˮ����ͼ1����ת��Ϊ�ֲ�Ʒ��

��1�����������Ŀ���ǽ���ˮ�е�H3AsO3��H3AsO4ת��Ϊ�Ρ�H3AsO4ת��ΪNa3AsO4��Ӧ�Ļ�ѧ����ʽ��_______________________________��
��2����������ʱ��1molAsO33-ת��ΪAsO43-������ҪO2______ mol��
��3�������顱�ǽ���Ԫ��ת��ΪCa5(AsO4)3OH��������������Ҫ��Ӧ�У�
a��Ca(OH)2��s��![]() Ca2+��aq��+2OH-��aq�� ��H��0
Ca2+��aq��+2OH-��aq�� ��H��0
b��5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH ��H��0
Ca5(AsO4)3OH ��H��0
�о������������顱������¶���85�档 �û�ѧƽ��ԭ�������¶ȸ���85���,���¶����߳������½���ԭ����_____________________��
��4������ԭ��������H3AsO4ת��ΪH3AsO3����Ӧ�Ļ�ѧ����ʽ��_______________________��
��5������ԭ���������Һ��H3AsO3�ֽ�ΪAs2O3��ͬʱ�ᾧ�õ���As2O3��As2O3�ڲ�ͬ�¶ȺͲ�ͬŨ�������е��ܽ�ȣ�S��������ͼ2��ʾ��Ϊ����ߴ�As2O3�ij����ʣ����ᾧ�����̽��еIJ�����_______��

��6������˵���У���ȷ���� ______ ������ĸ����
a����As2O3���CaSO4
b����ҵ�����У���Һ2��ѭ��ʹ�ã������Ļ�����
c��ͨ���ȡ����顱���ữ����˳���Դﵽ������Ԫ�ص�Ŀ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com