
分析 (1)依据胶粒吸附带电离子分析判断;
(2)依据胶体的性质分析判断;
(3)从溶液和胶体的分离分析判断;
(4)从胶体的性质聚沉分析判断.
解答 解:(1)Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,说明胶粒吸附了正电荷,这种现象为电泳,故答案为:E;
(2)强光通过Fe(OH)3胶体,可看到光带,是粒子对光的散射作用形成的是胶体的性质,称为丁达尔现象,故答案为:D;
(3)淀粉与食盐的混合液放在肠衣中,并把它悬挂在盛有蒸馏水的烧瓶里,从而使淀粉与食盐分离,利用了胶体不能通过半透膜的性质,称为渗析,故答案为:A;
(4)Fe(OH)3胶体加硅酸胶体,胶体变得浑浊,是因为氢氧化铁胶体微粒吸附正电荷,硅酸胶体微粒吸附负电荷,二者混合会发生聚沉,是胶体的性质,故答案为:C.
点评 本题考查了胶体的性质应用,主要是电泳、丁达尔现象、渗析、聚沉等性质的判断,较简单.


科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 d>c>b>a | |
| B. | 单质的还原性D<C<B<A | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 s | B. | 2.5 s | C. | 5 s | D. | 10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
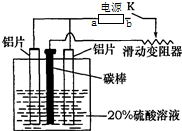 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com