
| A. | 含有食品添加剂的物质均对人体健康有害 | |
| B. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
分析 A.按照食品法规定的符合添加剂标准的食物对人体健康无害;
B.蛋白质要在催化剂作用下才能水解为氨基酸;
C.SiCl4(极易水解)水解后生成硅酸和氯化氢;
D.明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质.
解答 解:A.合理使用食品添加剂,对丰富食品生产和促进人体健康有好处,可以食用,但不能过量,故A错误;
B.豆浆煮沸是蛋白质发生了变性,故B错误;
C.SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体,故C正确;
D.明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水发生水解反应,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,不能作漂白剂,故D错误;
故选C.
点评 本题考查了生活中常见物质的性质及用途,明确食品添加剂成分及性质,熟悉盐类水解规律及应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Fe、Mg | C. | Al、Mg | D. | Zn、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
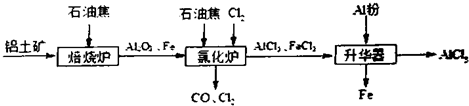
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯分子中2个碳原子都是sp2杂化,乙烯分子有5个σ键 | |
| D. | 乙烯和环丙烷(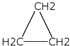 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:
六氰合铁(Ⅲ)酸钾K3[Fe(CN)6]俗称赤血盐,在医药工业、印染工业及钢铁工业均有重要作用,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
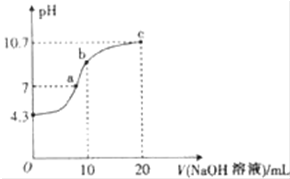 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com