
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
分析 由溶度积常数可知,溶度积越小,越难溶于水,越易生成沉淀,结合浓度对平衡移动的影响解答该题.
解答 解:A.由于Ksp(CuS)=1.3×10-36<Ksp(ZnS)=1.6×10-24<Ksp(FeS)=6.3×10-18,所以溶解度CuS<ZnS<FeS,故A错误;
B.ZnS饱和溶液中加入少量Na2S固体,c(S2-)增大,则c(Zn2+)减小,二者不等,故B错误;
C.由于Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.3×10-18,硫化铜的溶解度小于硫化亚铁的,所以除去工业废水中含有的Cu2+,可采用FeS 固体作为沉淀剂,故C正确;
D.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,溶度积最小的先沉淀,即Cu2+先沉淀出来,故D错误.
故选C.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意对溶度积常数的利用和理解.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、CO32-、I- | B. | H+、NO3-、Fe2+、Br- | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、S2-、Cu2+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
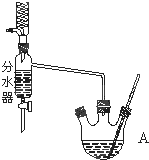 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
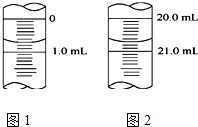 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com