
目前钢铁是日常生活中使用最广泛的金属,下列关于铁的一些说法正确的是( )。
A.常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
D.Fe3O4溶解于盐酸既有FeCl2又有FeCl3生成,故Fe3O4属于混合物
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
在氯化铁溶液中存在下列平衡:
FeCl3+3H2O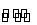 Fe(OH)3+3HCl ΔH>0
Fe(OH)3+3HCl ΔH>0
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体。向这种液体中加MgCl2溶液,产生的现象为______________________________。
(2)不断加热FeCl3溶液时,蒸干其水分并灼烧得到的固体可能是_________。
(3)在配制FeCl3溶液时,为防止浑浊,应加入_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
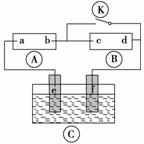
(1)电源A上的a为_________________________________________________极。
(2)滤纸B上发生的总化学反应方程式为___________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为
________________________________________________________________________,
电极f上发生的反应为______________________________________________,
槽中盛放的电镀液可以是__________或__________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示:

下列说法不正确的是( )。
A.氨可用作制冷剂
B.铵态氮肥一般不能与碱性化肥混合使用
C.硝酸可用于制化肥、农药、炸药、染料、盐类等
D.某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究新制饱和氯水的组成和性质而进行了如下科学实验:先观察了氯水的外观性质以后,再用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。请回答下列问题:
(1)写出新制饱和氯水中含有氯元素物质的化学式:
__________________________________________。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:____________________。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
①__________________________________________。
②__________________________________________。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②________________,振荡试管。
[实验现象及结论]
①若________________,则证明溶液红色褪去的原因是①而不是②;
②若________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )。
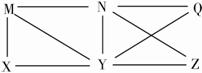
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[H2]m[Cl2]n,式中k为常数,m、n值可用下表中数据确定。
| [H2]/mol·L-1 | [Cl2]/ mol·L-1 | v/mol·L-1·s-1 |
| 1.0 | 1.0 | 1.0 k |
| 2.0 | 1.0 | 2.0 k |
| 2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1、n=1 B.m=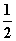 、n=
、n=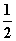
C.m=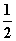 、n=1 D.m=1、n=
、n=1 D.m=1、n=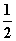
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
________________________________________________________________________
_______________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
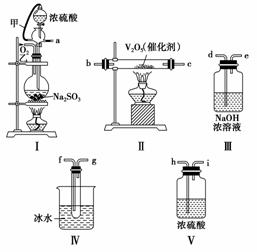
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com