
【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
I.单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2OH3O++OH-),IF5的自偶电离方程式为_________。
II.一种回收并利用含碘(I-)废液的工艺流程如下:

(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是_______________。
(2)“沉淀”中生成CuI的离子方程式为_______________。
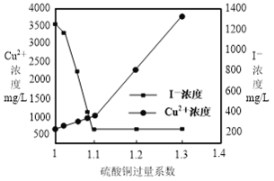
(3)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_______________,分析原因_______________。
(4)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(5)氯化银复合吸附剂可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=0.10molL-1。则溶液中c(I-)= ______molL-1。[Ksp(AgCl)=2.0×10-10,Ksp (AgI)=8.4×10-17]。该方法能去除碘离子的原理是_________。
(6)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
【答案】2IF5IF4++IF6-, 用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,加入淀粉及FeCl3溶液,若出现蓝色,则含有I-,或加入AgNO3溶液,若含有黄色沉淀生成,则含有I- 2Cu2++2I-+SO32-+2H2O = 2CuI↓+SO42-+2H+ 1.1 小于1.1则I-去除率较低,大于1.1又会引入较多的重金属离子Cu2+ 催化剂 Fe3I8+4K2CO3 = Fe3O4+8KI+4CO2↑ 4.2×10-8, 原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。 91.3%。
【解析】
I.水的电离方程式确定IF5电离方程式,从而确定其阳离子和阴离子;
II.结合流程可以知道回收废液中碘离子的步骤为:先向废液中加入亚硫酸钠、硫酸铜溶液生成CuI沉淀,过滤得到滤渣CuI,然后加入浓硝酸氧化Cul,向氧化产物中加入碘单质、铁屑和水后得到Fe3I8,Fe3I8与碳酸钾溶液发生反应Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑;过滤后将反应II的滤液经过加热浓缩、冷却结晶、过滤,初步得到碘化钾;因为碘化钾混有可溶性杂质,需要经过洗涤才能得到较纯净的产品,同时为了减少KI的溶解损失,需要用冰水洗涤,最后得到纯净的氯化钾,据此分析。
I.由水的电离方程式知,IF5的自偶电离方程式为:2IF5IF4++IF6-;
II.(1)检验碘可以用淀粉也可以用四氯化碳萃取,检验I-时为防止碘的干扰,需先充分萃取出碘,再在水层中加入淀粉及氧化剂(FeCl3、H2O2及氯水均可),所以用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中,加入淀粉及FeCl3溶液,观察溶液是否出现蓝色,或加入AgNO3溶液,看是否有黄色沉淀生成;
(2)根据流程图,沉淀池中SO32-被氧化为SO42-,Cu2+被还原为Cu+与I-结合为CuI沉淀,离子反应为:2Cu2++2I-+SO32-+H2O = 2CuI↓+SO42-+2H+;
(3)根据图示,当CuSO4过量系数小于1.1时I-去除率较低,大于1.1又会引入较多的重金属离子Cu2+;
(4)反应Ⅰ产物中不含H、O元素,加入水可能是为了加快反应速率,水起催化作用;根据铁与碘的质量比为21:127,可知铁与碘的物质的量比是![]() ,所以反应Ⅰ中生成铁与碘的化合物是Fe3I8;根据流程图反应Ⅱ是Fe3I8、K2CO3生成Fe3O4、KI、CO2;
,所以反应Ⅰ中生成铁与碘的化合物是Fe3I8;根据流程图反应Ⅱ是Fe3I8、K2CO3生成Fe3O4、KI、CO2;
(5)吸附反应为I-(aq) +AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后,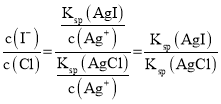 ,则
,则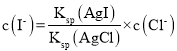 ,去除碘离子的原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。
,去除碘离子的原理是AgI溶度积比AgCl的溶度积小,发生沉淀的转化。
(6)依据滴定反应:Ag++I-=AgI↓,KI的质量分数为: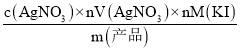 ×100%=
×100%=![]() ×100%=91.3%。
×100%=91.3%。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法正确的是( )
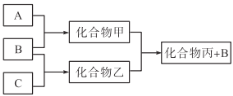
A.化合物乙是一种酸性氧化物B.丙沸点比甲高,是因为丙的相对分子质量更大
C.原子半径大小关系X<Y<ZD.X、Y、Z三种元素形成的化合物不一定是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
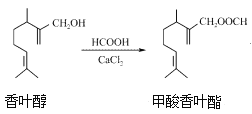
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在横线上。
同位素____;同一种物质___;同系物____;同分异构体____;同素异形体___。
①金刚石与石墨; ②D与T; ③12C和13C; ④O2与O3; ⑤CH4和CH3CH2CH3;⑥CH2=CHCH3和CH2=CH2;⑦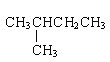 和CH3(CH2)3CH3 ⑧
和CH3(CH2)3CH3 ⑧ 和
和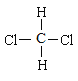
⑨三氯甲烷和氯仿 ⑩CH2=CHCH3和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向等体积(V0mL)等浓度(0.1 mol .L-1)的盐MCl、NaR、MR溶液中分别加入蒸馏水,使其稀释VmL,稀释过程中,溶液的pH与lg![]() 的关系如图所示。下列有关说法正确的是
的关系如图所示。下列有关说法正确的是
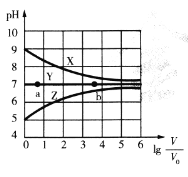
A.曲线X对应的盐为NaR,MCl为强酸强碱盐
B.对于曲线Y,a点水的电离程度比b点小
C.常温下,MOH的电离平衡常数Kb的数量级为10-3
D.曲线Z上任何一点对应溶液中均存在c(H+) =c(OH-) +c( MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
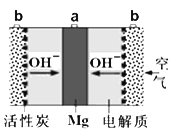
A. 电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B. 正极反应式为:Mg-2e-=Mg2+
C. 活性炭一极为正极
D. 电子的移动方向由a经外电路到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol H2(g)中的H—H键需要吸收436.4 kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498 kJ的能量,生成H2O(g)中的1 mol H—O键能放出462.8 kJ的能量。下列说法正确的是( )
A. 断裂1 mol H2O中的化学键需要吸收925.6 kJ的能量
B. 2H2(g)+O2(g)===2H2O(g) ΔH=-480.4 kJ·mol-1
C. 2H2O(l)===2H2(g)+O2(g) ΔH=471.6 kJ·mol-1
D. H2(g)+![]() O2(g)===H2O(l) ΔH=-240.2 kJ·mol-1
O2(g)===H2O(l) ΔH=-240.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
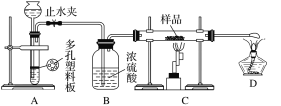
(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
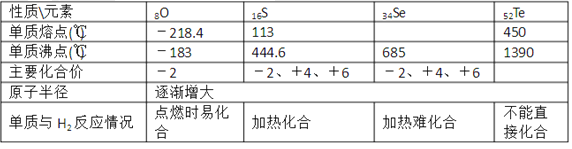
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com