
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
分析 反应2A(g)+B(g)?3C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为ωmol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol,n(B)=1mol即可,据此进行分析.
解答 解:A、该反应是气体体积不变的反应,压强不影响平衡,开始加入4molA+2molB,与加入2molA和1molB达平衡的平衡为等效平衡,达到平衡时C的浓度为2ωmol/L,故A错误;
B、开始加入3molC+2molD,则先将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入2molA、1molB所到达的平衡,达到平衡时C的浓度为ω mol/L,再多加1molD是固体,不会引起平衡的移动,故B正确;
C、1molB+3molC+1molD,按化学计量数转化到左边可得2molA、2molB,与原反应不是等效平衡,达到平衡时C的浓度为不是ω mol/L,故C错误;
D、2molA+1molB+3molC+1molD,按方程式的化学计量数转化到左边,可得4molA、2molB与原反应成比例等效平衡,达到平衡时C的浓度为2ω mol/L,故D错误;
故选:B.
点评 考查化学平衡的有关计算、等效平衡,难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:1、恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;2、恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.


科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl、H2SO4、NH3•H2O | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NaOH | D. | HCl、NaOH、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
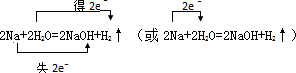 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
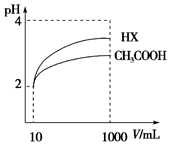 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2++2OH-═Mg(OH)2↓ Mg(NO3)2+Ba(OH)2═Mg(OH)2↓+Ba(NO3)2 | |
| B. | Fe+Cu2+═Fe2++Cu Fe+CuO═FeO+Cu | |
| C. | Ag++Cl-═AgCl↓ Ag2SO4+2HCl═2AgCl↓+H2SO4 | |
| D. | CO2+2OH-═CO32-+H2O CO2+2NH3•H2O═(NH4)2CO3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com