
(15分)X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和。请回答下列问题:
(1)X、W的元素符号依次为 、 ;
(2)写出Y2的电子式____________________;
(3)WZ2与XZ2分子的空间结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式);
(4)Q在元素周期表 区(填s、p、d、ds、f),其外围电子排布式为 ,在形成化合物时它的最高化合价为 。
(15分)(1)C
S (各2分)(2)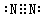 (2分)
(2分)
(3)V形 直线形 SO2 (各1分)
(4)d(2分) 3d54s1 (2分) +6(2分)
【解析】根据元素的结构和性质可判断,X、Y、Z、W、Q 五种元素分别是C、N、O、S、Cr。
(2)氮气中含有3对电子对,所以电子式为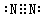 。
。
(3)SO2和CS2中中心原子含有对孤对电子分别是2对和0,所以前者是V形,后者是直线型。由于水水极性分子,所以根据相似相溶原理可知SO2在水中的溶解度大。
(4)区大名称来自于按构造原理最后填入电子的能级的符号,所以根据构造原理可知,铬元素是d区,其外围电子排布式为3d54s1 。外围电子共计6铬,所以最高价是+6价。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
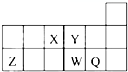 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )| A、元素Y最高正化合价与最低负化合价的绝对值之和的数值等于8 | B、原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) | C、离子Y2-和Z3+半径的大小顺序为:r(Y2-)>r(Z3+) | D、元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com