
| 酸 | 电离常数 |
| CH3COOH | Ki=1.8×10 -5 |
| H2CO3 | Ki1=4.3×10 -7,Ki2=5.6×10 -11 |
| H2S | Ki1=9.1×10 -8,Ki2=1.1×10 -12 |
| H3PO4 | Ki1=7.5×10 -3,Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
| A. | CH3COONa | B. | Na2CO3 | C. | Na2S | D. | Na3PO4 |
分析 弱酸的电离平衡常数越大,其酸性越强,其弱酸根离子水解程度就越小,结合电离常数分析解答,注意多元弱酸的分级电离.
解答 解:弱酸的电离平衡常数越大,其酸性越强,所以酸性:H2S<H2CO3<CH3COOH<H3PO4,但H3PO4的三级电离Ki3=2.2×10 -13远小于H2S的二级电离Ki2=1.1×10 -12,但H2CO3的二级、一级电离Ki1=4.3×10 -7,Ki2=5.6×10 -11远小于CH3COOH的电离Ki=1.8×10 -5,所以0.10mol/L的对应的盐其碱性为:Na3PO4>Na2S>Na2CO3>CH3COONa,碱性越强,PH越大,
故选D.
点评 本题考查弱电解质的电离和盐类的水解知识,注意弱酸的电离平衡常数越大,其酸性越强,其弱酸根离子水解程度就越小,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶液稀释到原体积的2倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 加少量冰醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠固体 | B. | 少量锌粉 | C. | 硫酸钾溶液 | D. | 盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
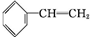 +Br2→
+Br2→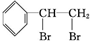 ;
; ;
;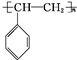 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶于水能形成H+和SO42-,说明H2SO4是离子化合物 | |
| B. | HCl气体溶于水,HCl分子里共价键被破坏 | |
| C. | 单质分子中不存在化学键,化合物分子中才存在化学键 | |
| D. | 含金属元素的离子一定是阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com