
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
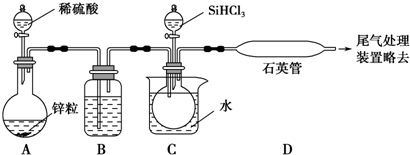
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
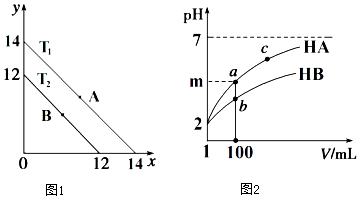 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是浓氨水 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热为221KJ/mol | |
| B. | 稀盐酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
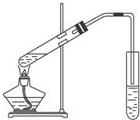 (A)如图为实验室用CH3COOH与CH3CH218OH制备乙酸乙酯的装置.
(A)如图为实验室用CH3COOH与CH3CH218OH制备乙酸乙酯的装置.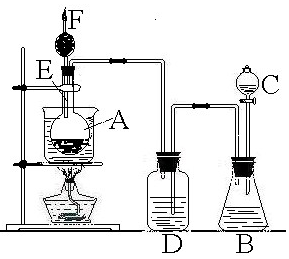
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com