
������������Դ�������ȷ������Ź㷺����;��ʪ�����ɷ��Ʊ��������ε�ԭ�����±���ʾ��
��1����ҵ����ʪ���Ʊ�������أ�K2FeO4������������ͼ��ʾ��
|
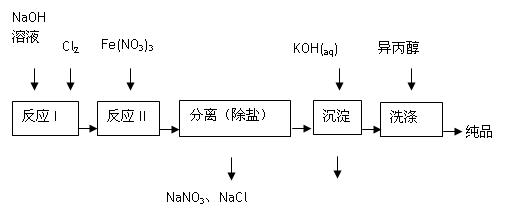

��ϴ�Ӵ�Ʒʱѡ�������������ˮ�������ǣ� ��
�ڷ�ӦI�Ļ�ѧ����ʽΪ ��
�۷�ӦII�����ӷ���ʽΪ ��
����֪25��ʱFe(OH)3��Ksp = 4.0��10-38����ӦII�����Һ��c(Fe3+)=4.0��10-5 mol/L,����Ҫ����pH= ʱ����ʼ����Fe(OH)3����������Һ����ı仯����
��2��������ͼ�ɼ���ʪ���Ʊ��������ʱ�������Ƶø������ƣ�Ȼ��������������м��뱥��KOH��Һ����������������ء�
�ټ��뱥��KOH��Һ��Ŀ���ǣ� ��
����������Ϣ��֪��������ص��ܽ�ȱȸ������� �����С������
| ʪ�� | ǿ���Խ����У�Fe(NO3)3��NaClO��Ӧ�����Ϻ�ɫ����������Һ |
| �ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ��� |
��3���ɷ��Ʊ�K2FeO4�ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ ��
���𰸡�����15�֣�����1����3��������ÿ��2�֣�
��1���ټ��ٸ�����ص��ܽ���ʧ��2�֣�
��2NaOH+Cl2=NaCl+NaClO+H2O��2�֣�
��3ClO��+10OH��+2Fe3+=2FeO42��+3Cl��+5H2O��3�֣�
��3��2�֣�
��2��������K��Ũ�ȣ��ٽ�K2FeO4����������2�֣� ��С��2�֣�
��3��3:1��2�֣�
��������
���������
��1���ټ���������ˮ�����л��ܼ����Ա�����ε���ʧ
���������������Ʒ�Ӧ�����Ȼ��ơ��������ơ���ˮ��
����һ����Ӧ�����˴����������ΪΨһ�������������������������������Ӻ������Ρ�
��Ksp��Fe(OH)3����c3(OH-)��c(Fe3+)�����c(OH-)=10-11,����pH���㷨��pH=3.
��2����Ksp��K2FeO4����c2(K+)��c(FeO42-),�����Ӽ�����Ũ�ȿ�������K2FeO4���塣
�ڷ������ͬ�����Ƶķ����Ʊ�Na2FeO4�ˡ�
��3��N�õ�2�����ӣ�Fe �õ�3�����ӣ�����N*3��Fe *2,����Ϊ��Fe2O3(�ص���Fe2),�ʱ���Ϊ3: 1.
1.
���㣺����������ԭ��Ӧ���Լ��ǽ������ʼ��仯�����ѧ��Ӧԭ���ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л���A��̼���⡢������Ԫ����ɡ���ȡ3 g A��4.48 L����(��״��)���ܱ�������ȼ�գ����ɶ�����̼��һ����̼��ˮ����(���跴Ӧ��û��ʣ��)������Ӧ���ɵ���������ͨ��������Ũ����ͼ�ʯ�ң�Ũ��������3.6 g����ʯ������4.4 g���ش��������⣺
(1)3 g A������̼ԭ�ӡ���ԭ�ӵ����ʵ������Ƕ���? ��4�֣�
(2)ͨ������ȷ�����л���ķ���ʽ�� ��4�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ���ܻ�óɹ����� (�� ��)
A������ȩ����������Һ�У��������������
B������Ũ��ˮ��Ӧ��ȡ�屽
C�����м�Ũ��ˮ�۲����
D��1 mol·L��1 CuSO4��Һ2 mL��0.5 mol·L��1 NaOH��Һ4 mL��Ϻ����40%����ȩ��Һ0.5 mL��������й۲��������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йػ�ѧ�����˵���в���ȷ���ǣ� ��
A����OH�� ����ʾ�ǻ�
����ʾ�ǻ�
B��������ĽṹʽΪ��H��Cl��O
C��CH4���ӵ����ģ�ͣ�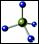
D�������ӵı���ģ�ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�����������˵������ȷ����
A��O2��O3�Ļ�����干6.4g������������ԭ����һ��Ϊ0.4NA
B������״����22.4LNO��11.2LO2��Ϻ�����ԼΪ22.4L
C���ڷ�ӦKClO4+8HCl=KCl+4Cl2��+4H2O�У�ÿ����4molCl2ת�Ƶĵ�����Ϊ8NA
D����״����11.2LCl2����1Lˮ�У�ת�Ƶ��ӵ���ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ��Ϊ�˲ⶨ��ͭ����Ҫ�ɷ���Cu2S����Cu2S�������������������ͼװ�á�ʵ��ʱ�����²��������
A.���Ӻ�������ʹ���Ϊ��ͼװ�ã������װ�õ������ԡ�
B.��ȡ��ϸ�Ļ�ͭ����Ʒ1.000g��
C.�������õ���ƷС�ĵط���Ӳ�ʲ������С�
D.��ÿ����1L�����ʹ��������
E.��Ӳ�ʲ������еĻ�ͭ����Ʒ���ȵ�һ���¶�,������ӦΪ:Cu2S+O2 SO2 +2Cu��
SO2 +2Cu��
F.��ȡ25.00mL��SO2��ˮ��Һ��250mL��ƿ�У���0.0100mol/L KMnO4����Һ�ζ����յ㡣���������������ظ��ζ�2��3�Ρ�
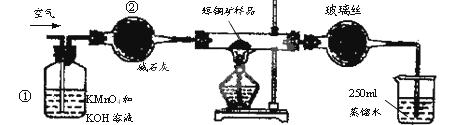
�Իش��������⣺
��1��װ�âٵ�������_________________��װ�âڵ�������____________________��
��2���ٶ���ͭ���е���ȫ��ת��ΪSO2������ȫ����ˮ���գ������F����������Ӧ�Ļ�ѧ����ʽΪ ��������_______________________________������ʱ���жϵζ��Ѿ��ﵽ�յ㡣
��3��������F�ĵζ�������±���ʾ�����ͭ����Ʒ��Cu2S������������________��
| �ζ� ���� | ������Һ��[��Դ:Z.X.X.K] ���/mL | ����Һ����� | |
| �ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
��4���������������һ�����Ե�ȱ��Ӱ���˲ⶨ����������ڲ���ʧ������Ϊ�� ��дһ�ּ��ɣ���
��5����֪�ڳ�����FeS �� Ksp�� 6 . 25 �� 10 ��18, H2S ������Һ�� c (H������ c (S2����֮��������¹�ϵ��c2 (H��)����S2��) = 1 . 0��10��22 ���ڸ��¶��£������� FeS Ͷ�����ⱥ����Һ�У���ʹ��Һ�У�Fe2+��Ϊ1 mol/L��Ӧ������Һ��c��Hʮ��Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ԫ�������ɷ���������˵���������(����)
A��Ra�ǵ������ڵڢ�A���Ԫ�أ�Ra(OH)2�ļ��Ա�Mg(OH)2�ļ���ǿ
B��As�ǵ������ڵڢ�A���Ԫ�أ�AsH3�Ļ�ԭ�Ա�NH3�Ļ�ԭ����
C��Cs��ԭ�Ӱ뾶��Na��ԭ�Ӱ뾶��Cs��ˮ��Ӧ��Na��ˮ��Ӧ������
D��Cl�ĺ˵������Al�ĺ˵������Cl��ԭ�Ӱ뾶��Al��ԭ�Ӱ뾶С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ���ǣ� ��
A�������Ӳ֬�ụΪͬϵ�C2H6��C9H20Ҳ��Ϊͬϵ��
B������������������Ӫ�����ʣ��侧����Ҫ��������ʽ���ڣ�������Һ��pH�ɸı������ܽ��
C��������ͱ���������ˮ����������3�ֶ���
D��������Һ�м��뱥��(NH4)2SO4��Һ���г����������ټ�ˮ�������ܽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com