
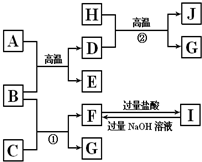
 图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.
图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.分析 B是地壳中含量最高的金属元素,则B为Al,H与D在高温下得到G、J,G是气体,J是磁性材料,常温下H为无色液体,该转化为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故D为Fe,H为H2O,J为Fe3O4,G为H2,故A与B的反应为铝热反应,则A为Fe2O3,E为Al2O3;由反应①Al+C→F+H2,C为酸或碱,F为铝盐或偏铝酸盐,由F与I相互可知,F为NaAlO2,I为AlCl3,故C为NaOH.
解答 解:B是地壳中含量最高的金属元素,则B为Al,H与D在高温下得到G、J,G是气体,J是磁性材料,常温下H为无色液体,该转化为Fe+H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+H2,故D为Fe,H为H2O,J为Fe3O4,G为H2,故A与B的反应为铝热反应,则A为Fe2O3,E为Al2O3;由反应①Al+C→F+H2,C为酸或碱,F为铝盐或偏铝酸盐,由F与I相互可知,F为NaAlO2,I为AlCl3,故C为NaOH,
(1)反应①是铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)反应②的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)Fe3O4与盐酸反应生成FeCl2、FeCl2与H2O,反应方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,
反应后的溶液中铁离子能被Fe还原得到亚铁离子,反应的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;2Fe3++Fe═3Fe2+;
(4)J与盐酸反应后的溶液再与足量D反应所得溶液中金属阳离子为Fe2+,检验的方法是在试管中取少量B溶液,滴加KSCN溶液,溶液不变红色,再滴加Cl2水(或H2O2溶液),溶液变红色,则含有Fe2+,反之则无,
故答案为:在试管中取少量B溶液,滴加KSCN溶液,溶液不变红色,再滴加Cl2水(或H2O2溶液),溶液变红色,则含有Fe2+,反之则无.
点评 本题以框图形式,考查无机物推断,完成此类题目,关键是找准解题的突破口,再利用顺推法、逆推法相结合进行推断,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式M(g)+3N(g)?2R(g)△H>0 | |
| B. | 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 | |
| C. | 达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小 | |
| D. | 达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种氧化物对应的水化物中,Al(OH)3酸性最强 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g46%的乙醇溶液所含氢原子数为1.2 NA | |
| B. | 0.5 mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24 L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
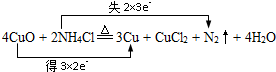 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在屋顶安装太阳能热水器为居民提供生活用水 | |
| B. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 | |
| C. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气作为家庭燃气 | |
| D. | 大力发展火力发电,解决广东电力紧张问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com