
| A. | HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | |
| B. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| C. | ⅠA金属元素是同周期中金属性最强的元素 | |
| D. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 |
分析 A.非金属性越强,对应氢化物的稳定性越强,还原性越弱;
B.形成离子键的阴阳离子间为静电作用力;
C.同周期从左向右金属性减弱;
D.非金属性越强,得到电子能力越强,对应最高价氧化物对应水化物的酸性越强.
解答 解:A.非金属性F>Cl>Br>I,则HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,故A正确;
B.形成离子键的阴阳离子间为静电作用力,含静电吸引力和静电排斥力,故B错误;
C.同周期从左向右金属性减弱,则ⅠA金属元素是同周期中金属性最强的元素,故C正确;
D.非金属性为Cl>S>P,P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强,故D正确;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | |
| 二 | a | b | c | ||||
| 三 | d | e | f | g | h | i |
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的物质的量甲<乙 | ||
| C. | 平均反应速度:乙>甲 | D. | 平衡时A的物质的量甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
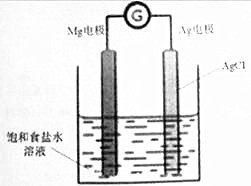 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )| A. | 镁电极上发生还原反应 | |
| B. | 银电极的电极反应式:AgCl+e-=Ag+Cl- | |
| C. | 该装置中能最转化方式为电能转化为化学能 | |
| D. | 电池工作时,钠离子移向镁电极,氯离子移向银电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中各组分的浓度发生改变 | B. | 平衡体系中气体密度发生改变 | ||
| C. | 正、逆反应速率不相等了 | D. | 平衡体系中气体压强发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉可用于养殖业消毒杀菌 | B. | SiO2可用于制光导纤维 | ||
| C. | FeCl3溶液可用于蚀刻铜制线路板 | D. | AlCl3可用于电解冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com