
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
分析 该燃料电池中,通入燃料甲醇的电极是负极,负极反应式为2CH3OH+16OH--12e-=2CO32-+12H2O,通入氧气的电极是正极,正极反应式为6H2O+3O2+12e-=12OH-,放电时电解质溶液中阴离子向负极移动、阳离子向正极移动,再结合甲醇和转移电子之间的关系式计算.
解答 解:A.通入氧气的电极上得电子发生还原反应,所以为原电池正极,故A错误;
B.放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,所以溶液中的OH-向负极移动,故B错误;
C.放电时,甲醇失电子发生氧化反应,被氧化,根据2CH3OH+16OH--12e-=2CO32-+12H2O知,若有6mol电子发生转移,则被氧化的CH3OH质量=$\frac{6mol}{12mol}×2mol×32g/mol$=32g,故C错误;
D.负极反应式为2CH3OH+16OH--12e-=2CO32-+12H2O,负极上氢氧根离子参加反应且生成水,导致氢氧根离子浓度减小,溶液的pH减小,故D正确;
故选D.
点评 本题考查化学电源新型电池,明确各个电极上发生的反应、离子移动方向即可解答,易错选项是C,注意还原剂被氧化.


科目:高中化学 来源: 题型:选择题
| A. | 该晶体中一定含有SCN- | |
| B. | Fe3+的氧化性比Br2的氧化性强 | |
| C. | Fe2+被Br2氧化为Fe3+ | |
| D. | Fe2+ 与SCN-不能形成血红色的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2分别通入BaCl2、Ba(NO3)2溶液中,都会观察到有白色沉淀生成 | |
| B. | 检验某酸性溶液中Cl-、SO42-,选用试剂及顺序是过量的AgNO3溶液、Ba(NO3)2溶液 | |
| C. | 纯锌与稀硫酸反应产生氢气的速率较慢,加入少量硫酸铜固体后,反应速率会加快 | |
| D. | 对于任意化学平衡,只要增大反应物浓度,都会使反应物转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
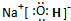 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
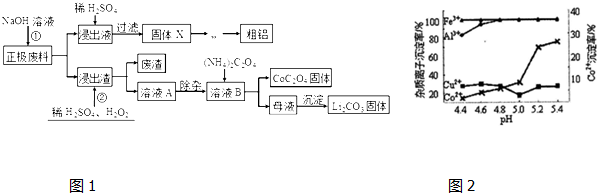
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为AFD |
 ;c的结构式为H-O-Cl.
;c的结构式为H-O-Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol•L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气速率不变 | |
| B. | 铁和稀硫酸反应制取氢气时,改用铁片和浓硫酸可加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com