
| A. | 原CuSO4溶液的浓度为1mol/L | |
| B. | 若要使电解后的溶液恢复至电解前的CuSO4溶液,则需加入9.8gCu(OH)2固体 | |
| C. | 电解过程中转移电子数为0.4NA个 | |
| D. | 假设电解过程中忽略溶液体积变化,则电解后所得溶液中C(H+)=0.1mol/L |
分析 用Pt做电极电解100moLCuSO4溶液,开始时阳极上OH-放电生成O2,阴极上Cu2+放电生成Cu,当Cu2+完全放电后,溶液中H+放电生成H2,电解一段时间后生成的n(H2)=n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
A.根据转移电子相等计算n(Cu2+),再根据Cu原子守恒计算c(CuSO4);
B.阳极上生成氧气、阴极上生成Cu和氢气,所以相当于析出CuO和H2O,根据“析出什么加入什么”原则加入物质使溶液恢复原状;
C.根据氧气与转移电子之间的关系式计算转移电子数;
D.第一步电解生成氢离子,第二步电解实际上是电解水,溶液中n(H+)不变,根据Cu和H+之间的关系式计算.
解答 解:用Pt做电极电解100moLCuSO4溶液,开始时阳极上OH-放电生成O2,阴极上Cu2+放电生成Cu,当Cu2+完全放电后,溶液中H+放电生成H2,电解一段时间后生成的n(H2)=n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
A.根据转移电子相等得n(Cu2+)=$\frac{0.1mol×4-0.1mol×2}{2}$=0.1mol,再根据Cu原子守恒得n(CuSO4)=n(Cu)=0.1mol,c(CuSO4)=$\frac{0.1mol}{0.1L}$=1mol/L,故A正确;
B.阳极上生成氧气、阴极上生成Cu和氢气,所以相当于析出CuO和H2O,根据Cu原子守恒得n(CuO)=n(Cu)=0.1mol,根据H原子守恒得n(H2O)=n(H2)=0.1mol,根据“析出什么加入什么”原则加入物质使溶液恢复原状,则进入的物质质量=m(CuO)+m(H2O)=0.1mol×80g/mol+0.1mol×18g/mol=9.8g,Cu(OH)2可以改写为CuO.H2O,故B正确;
C.根据氧气与转移电子之间的关系式计算转移电子数为0.1mol×4×NA/mol=0.4NA,故C正确;
D.第一步电解生成氢离子,第二步电解实际上是电解水,溶液中n(H+)不变,铜离子放电时离子方程式为2Cu2++2H2O=O2↑+2Cu+4H+,根据Cu和氢离子关系式得n(H+)=2n(Cu)=2×0.1mol=0.2mol,
c(H+)=$\frac{0.2mol}{0.1L}$=2mol/L,故D错误;
故选D.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确离子放电顺序、阴极上产生成分及各个物理量之间的关系式是解本题关键,注意该题中原子守恒、转移电子守恒的灵活运用,难点是B选项的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构式:CH2═CH2 | B. | Na2O的电子式: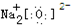 | ||
| C. | K+的电子排布式:1S22S22P63S23P6 | D. | 硝酸钾的分子式:KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
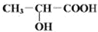 已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题: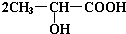 +Na2CO3→
+Na2CO3→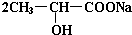 +H2O+CO2↑.
+H2O+CO2↑.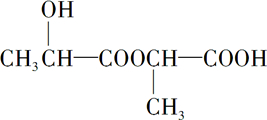 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
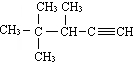 的系统名称为( )
的系统名称为( )| A. | 2,2,3一三甲基一1-戊炔 | B. | 2,2,3一三甲基一4一戊炔 | ||
| C. | 3,4,4一三甲基戊炔 | D. | 3,4,4一三甲基一l一戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW均为1×10-14 | B. | 若a=12则b=2 | ||
| C. | a、b为固定值 | D. | 水电离出的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径大小:D>B>A | |
| B. | B的单质既能和酸反应,又能和碱反应 | |
| C. | A分别与C、D形成的化合物均易溶于水 | |
| D. | 最高价氧化物对应水化物的酸性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
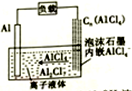 最近报道的一种能快速充放电的离子电池,其中的电解质为离子液体{AlCl4-/[EMI]+},放电时有关离子转化如图所示.下列说法正确的是 ( )
最近报道的一种能快速充放电的离子电池,其中的电解质为离子液体{AlCl4-/[EMI]+},放电时有关离子转化如图所示.下列说法正确的是 ( )| A. | 放电时,负极发生2AlCl4--e-═Al2Cl7-+Cl- | |
| B. | 放电时,有机阳离子[EMI]+向铝电极方向移动 | |
| C. | 充电时,阴极发生:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 充电时,泡沫石墨极与外电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com