
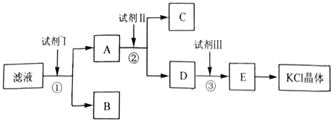
 某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质.他们采用了以下操作制备胶体,请将空白处填写完整.分析 (1)实验室制备氢氧化铁胶体的方法为:向沸水中滴加饱和氯化铁溶液加热到红褐色;
(2)胶体不能透过半透膜,而溶液是可以的;
(3)氢氧化铁胶体的胶粒带正电荷,向阴极移动;
(4)①依据胶体聚沉的性质解答;
②氢氧化铁与氢碘酸发生酸碱中和反应;
③三价铁离子具有强的氧化性,能够氧化碘离子.
解答 解:(1)将小烧杯中20mL蒸馏水加至沸腾,向沸水中逐滴加入1mL~2mL氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,故答案为:氯化铁溶液;溶液出现红褐色;
(2)胶体不能透过半透膜,而溶液是可以的.所以半透膜外的液体是不能产生丁达尔效应的.由于溶液中含有氯离子,能和硝酸银反应生成白色氯化银沉淀,故答案为:无;出现白色沉淀;
(3)氢氧化铁胶体的胶粒带正电荷,所以向阴极移动,即阴极附近溶液颜色加深,故答案为:阴;氢氧化铁胶体粒子带正电;
(4)①碘化氢为可溶性电解质,能够使氢氧化铁胶体发生聚沉,出现红褐色沉淀;
故答案为:加入电解质,使胶体凝聚;
②氢氧化铁与氢碘酸发生酸碱中和反应:Fe(OH)3+3H+═Fe3++3H2O,所以沉淀溶解,溶液呈黄色;
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③三价铁离子具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为:2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深;
故答案为:有I2生成;2Fe3++2I-═I2+2Fe2+.
点评 本题考查了氢氧化铁胶体的制备方法和实验步骤、离子方程式的书写,难度不大,注意反应的条件应用和试剂的选择,试剂的滴加顺序.


科目:高中化学 来源: 题型:选择题
| A. | 一定有I- | B. | 可能含Fe3+ | C. | 可能有Cl- | D. | 不含NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaHCO3 | ||
| C. | Na2CO3和NaHCO3 | D. | NaOH、Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 说明该盐一定是碳酸盐 |
| B | 向某无色溶液中滴加BaCl2溶液,再滴加过量的稀HNO3,产生白色沉淀 | 该无色溶液中一定有SO42- |
| C | 向某无色溶液中滴加NaOH溶液,加热后,产生是湿润的红色石蕊试纸变蓝的气体 | 说明溶液液中含有NH4+ |
| D | 某无色气体通过灼热的CuO,CuO变为红色 | 该气体一定为氢气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅用途广泛,石英、水晶、光导纤维的主要成分都是二氧化硅 | |
| B. | 碘是人体必需微量元素,日常生活中食用的加碘盐中添加的是碘单质 | |
| C. | 漂白粉既可作棉、麻、纸张的漂白剂,又可作游泳池的消毒剂 | |
| D. | 燃煤时加入适量石灰石,可减少废气中SO2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 K2SO4溶液中含有0.6NA个K+和0.3 mol的SO42- | |
| B. | 在标准状况下H2O的摩尔体积约是22.4 L•mol-1 | |
| C. | 将58.5g的NaCl固体溶解在1L的水中,所得的溶液物质的量浓度为1mol/L | |
| D. | 1 mol任何气体在标准状况下的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

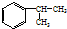 ,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是
,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是 (写结构简式).
(写结构简式). +nHCHO$→_{△}^{催化剂}$
+nHCHO$→_{△}^{催化剂}$ +nH2O.
+nH2O. G:
G: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com