
| 16.0g |
| 160g/mol |
| 19.1g-6.4g |
| 127g/mol |
| 16.0g |
| 160g/mol |
| 19.1g-6.4g |
| 127g/mol |


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
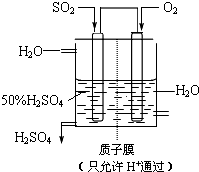 某人设想以如图所示装置用电化学原理生产硫酸,写入通入SO2的电极的电极反应式
某人设想以如图所示装置用电化学原理生产硫酸,写入通入SO2的电极的电极反应式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(H2SO4)=0.6mol c(H2SO4)>6mol/L |
| B、n(H2SO4)=0.3mol c(H2SO4)≥3mol/L |
| C、n(H2SO4)<0.3mol c(H2SO4)<3mol/L |
| D、0.3mol≤n(H2SO4)≤0.6mol 3mol/L≤c(H2SO4)≤6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数:W>Z>X>Y |
| B、离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
| C、Y的气态氢化物比X的气态氢化物稳定 |
| D、氢氧化物碱性强弱:W(OH)2>ZOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
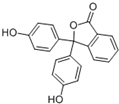
| A、分子式为C20H14O4 |
| B、可以发生取代反应、加成反应、氧化反应 |
| C、含有的官能团有羟基、酯基 |
| D、1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玻璃、陶瓷、水泥、光导纤维的化学组成都是硅酸盐 |
| B、液氨汽化时要吸收大量的热,可用作制冷剂 |
| C、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D、生石灰能与水反应,可用来干燥氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
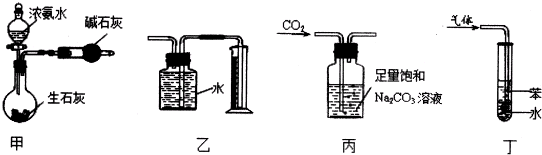
| A、甲装置制干燥的氨气 |
| B、用乙装置收集并测量Cu与浓硝酸反应产生的气体及体积 |
| C、用丙装置除去CO2中含有的少量HC1 |
| D、用丁装置吸收NH3,并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
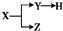 表示一些物质间的从属关系,不正确的是( )
表示一些物质间的从属关系,不正确的是( )| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 大雾 |
| B | 电解质 | 酸 | 碱 | 盐 |
| C | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com