

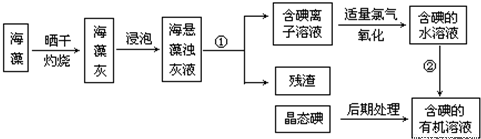
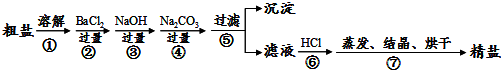
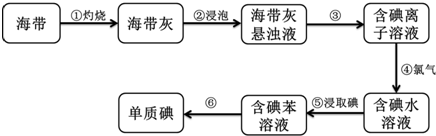
分析 (1)分离难溶性固体和溶液采用过滤方法,过滤时需要烧杯、玻璃棒、漏斗;
(2)从碘水中提纯碘,用分液漏斗萃取;分液漏斗使用前要检验是否漏水;
(3)分离互溶且沸点不同的液体采用蒸馏方法;
(4)碘遇淀粉试液变蓝色,所以可以用淀粉试液检验是否含有碘.
解答 解:(1)分离难溶性固体和溶液采用过滤方法,所以步骤③的实验操作名称是过滤,过滤时需要烧杯、玻璃棒、漏斗,
故答案为:过滤;烧杯、玻璃棒和漏斗;
(2)步骤⑤是从碘水中提纯碘,碘易溶于苯,用苯来萃取碘水中的碘;碘的苯溶液与水互不相溶会分层,用分液漏斗分离互不相溶的液体;分液漏斗使用前要检验是否漏水;
故答案为:萃取;分液漏斗;检验是否漏水;
(3)分离互溶且沸点不同的液体采用蒸馏方法,碘易溶于苯,但碘和苯的熔沸点不同,所以可以采用蒸馏的方法分离,
故答案为:蒸馏;
(4)碘遇淀粉试液变蓝色,所以可以用淀粉试液检验是否含有碘,其检验方法为:向该溶液中滴加淀粉试液,如果溶液变蓝色,则证明含有碘,否则不含碘,
故答案为:加入淀粉试液,若变蓝色,说明有碘.
点评 本题考查海水资源的综合利用,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,常见的分离方法有:过滤、蒸馏、渗析、加热等,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0-50min之间,pH=2和pH=7时R的降解百分率不相等 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度和溶液的pH均影响R的降解速率 | |
| D. | 在 20-25min之间,pH=10 时R的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com