

| A. | X气体可以是N2,目的是做保护气,抑制CuCl2•2H2O加热过程可能的水解 | |
| B. | CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O | |
| C. | 途径1中产生的Cl2可以回收循环利用,也可以通入饱和CaCl2溶液中除去 | |
| D. | 途径2中200℃下反应的化学方程式为:Cu2(OH)2Cl2$\frac{\underline{\;加热\;}}{\;}$2CuO+2HCl |
分析 热分解CuCl2•2H2O制备CuCl,为抑制CuCl2水解,要在HCl气流下加热,加热温度大于300℃,发生2CuCl2$\frac{\underline{\;大于300℃\;}}{\;}$2CuCl+Cl2↑,直接加热CuCl2•2H2O会生成Cu2(OH)2Cl2,Cu2(OH)2Cl2加热到200℃生成CuO,
A.X气体是用于抑制CuCl2水解;
B.CuCl不能写成离子;
C.Cl2在饱和CaCl2溶液中溶解度很小,不能被吸收;
D.Cu2(OH)2Cl2加热到200℃生成CuO,结合原子守恒书写方程式.
解答 解:热分解CuCl2•2H2O制备CuCl,为抑制CuCl2水解,要在HCl气流下加热,加热温度大于300℃,发生2CuCl2$\frac{\underline{\;大于300℃\;}}{\;}$2CuCl+Cl2↑,直接加热CuCl2•2H2O会生成Cu2(OH)2Cl2,Cu2(OH)2Cl2加热到200℃生成CuO,
A.CuCl2水解生成氢氧化铜和HCl,X气体是用于抑制CuCl2水解,则X为HCl,不是氮气,故A错误;
B.CuCl微溶于水,不能写成离子,CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++SO42-═2Cu2++SO2↑+2Cl-+2H2O,故B错误;
C.途径1中产生的Cl2可以转化为HCl,回收循环利用,Cl2在饱和CaCl2溶液中溶解度很小,不能被吸收除去,故C错误;
D.Cu2(OH)2Cl2加热到200℃生成CuO,由原子守恒可知,还生成HCl,则化学方程式为:Cu2(OH)2Cl2$\frac{\underline{\;加热\;}}{\;}$2CuO+2HCl,故D正确.
故选D.
点评 本题考查物质的制备实验,题目难度中等,把握制备实验原理、实验流程图、元素化合物知识为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验相结合的训练.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 光照条件下1molCH4与3molCl2反应可制得1molCHCl3 | |
| C. |  为苯分子的比例模型 为苯分子的比例模型 | |
| D. |  所有碳原子有可能都在同一个平面上 所有碳原子有可能都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.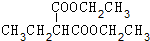 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | CH≡CH | CH2=CH2 | CH2BrCH2Br | CH2OHCH2OH |
| B | NaAlO2 | Al(OH)3 | Al2O3 | Al |
| C | CH3CH2OH | CH3CHO | CH3COOH | CH3COOC2H5 |
| D | SiO2 | H2SiO3 | Na2SiO3 | Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .由18O、16O、H、D原子组成的H2O2分子共有9种.
.由18O、16O、H、D原子组成的H2O2分子共有9种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.5 mol/(L•min) | B. | v(NH3)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.1mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 实验室用排饱和食盐水法收集氯气 | ||
| C. | 打开汽水瓶盖,即有大量氕泡逸出 | D. | 温度升高,纯水中的H+浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用铜和浓硫酸反应制取硫酸铜 | |
| B. | 实验室用铜和稀硝酸反应制取一氧化氮 | |
| C. | 工业上利用氮气与氢气制取氨气 | |
| D. | 工业上用焦炭还原三氧化二铁制取铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )| A. | 反应①属于取代反应 | |
| B. | W中有手性碳原子 | |
| C. | 仅使用溴水或FeCl3溶液不能鉴别X和W | |
| D. | X、Y、W、Z都能与NaOH溶液反应、都能使酸性高锰酸钾褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com