
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
分析 A.向NaOH溶液中慢慢滴加FeCl3饱和溶液,氢氧化钠互溶氯化铁反应生成氢氧化铁沉淀;
B.胶体与其他分散系的本质区别是分散质粒子的大小不同;
C.溶液中溶质粒子能通过半透膜,胶体中的分散质粒子不能通过;
D.胶体遇电解质发生聚沉.
解答 解:A.实验室制备氢氧化铁胶体是把饱和的FeCl3溶液倒入沸水中,加热至液体呈现红褐色时停止加热,得到Fe(OH)3 胶体,向NaOH溶液中慢慢滴加FeCl3饱和溶液,得到Fe(OH)3沉淀,故A正确;
B.胶体与其他分散系的本质区别是分散质粒子的大小不同,故B错误;
C.食盐溶液中溶质粒子能通过半透膜,淡粉溶液属于胶体,胶体中的分散质粒子不能通过,可以用渗析原理来分离,涉及胶体性质,故C正确;
D.胶体遇电解质发生聚沉,氢氧化铁沉淀可溶于硫酸,故D正确.
故选B.
点评 本题考查了氢氧化铁胶体的制备、胶体的性质、提纯等知识,题目难度不大,注意胶体与其它分散系的本质区别是分散质粒子的大小不同,不是丁达尔效应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C0(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
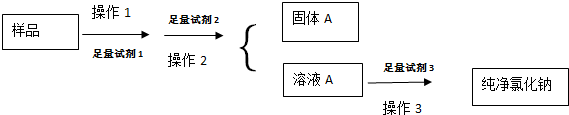
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
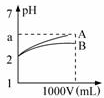 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )| A. | a=5时,A是强酸,B是弱酸 | |
| B. | 若A、B都是强酸,则5>a>2 | |
| C. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| D. | A、B两种酸溶液的物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
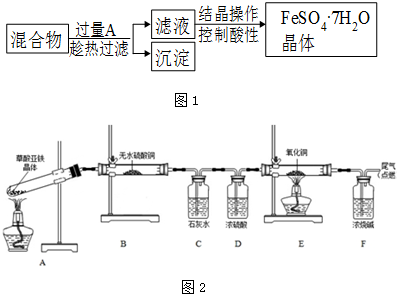
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下反应N2+3H2$?_{加热}^{催化剂}$2NH3,达到平衡时,3v正(H2)=2v正(NH3) | |
| B. | 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 | |
| C. | 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 | |
| D. | 常温下,向浓度为0.1mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com