
【题目】化合物J具有抗缺血性脑损伤的作用,合成J的一种路线如下:

已知:①
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
回答下列问题:
(1)D所含有官能团的名称 。
(2)由D生成E的化学方程式为 ,其反应类型为
(3)G的结构简式为 。
(4)C的某同系物X,相对分子质量比C大14,X的结构有 种,其中核磁共振氢谱为4组峰,且锋面面积比为1:2:2:2的是 (写结构简式)。
(5)由甲醛和化合物A经下列步骤可得到2-苯基乙醇。
![]()
反应条件1为 ;反应条件2所选择的试剂为 ;L的结构简式为 。
【答案】
(1)碳碳双键
(2)![]() ;加成反应;
;加成反应;
(3)![]() ;
;
(4)17;![]() 、
、![]() ;
;
(5)Cl2,光照(或Br2,光照);镁(或Mg),乙醚;![]() 。
。
【解析】
试题分析:根据A与溴反应生成B的化学式的关系可知,A与溴在铁作催化剂时发生苯环上的取代反应生成B,结合J的结构,A为甲苯![]() ,B为
,B为![]() ,则C为
,则C为![]() ;根据信息①,H为羧酸,结合J的结构,则H为
;根据信息①,H为羧酸,结合J的结构,则H为![]() ,G为
,G为![]() ,则F为(CH3)3CMgBr,D与HBr发生加成反应生成E,E的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr。
,则F为(CH3)3CMgBr,D与HBr发生加成反应生成E,E的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr。
(1)D为CH2=C(CH3)2,所含有官能团是碳碳双键,故答案为:碳碳双键;
(2)D为CH2=C(CH3)2,由D生成E的化学方程式为CH2=C(CH3)2+HBr→(CH3)3CBr,属于加成反应,故答案为:CH2=C(CH3)2+HBr→(CH3)3CBr;加成反应;
(3)G为![]() ,故答案为:
,故答案为:![]() ;
;
(4)C为![]() ,C的某同系物X,相对分子质量比C大14,X的结构有
,C的某同系物X,相对分子质量比C大14,X的结构有![]() (包括间位和对位,共3种)、
(包括间位和对位,共3种)、![]() (包括间位和对位,共3种)、
(包括间位和对位,共3种)、![]() (●为溴原子可能的位置,4种)、
(●为溴原子可能的位置,4种)、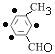 (●为溴原子可能的位置,4种)、
(●为溴原子可能的位置,4种)、![]() (●为溴原子可能的位置,2种)、
(●为溴原子可能的位置,2种)、![]() ,共17种,其中核磁共振氢谱为4组峰,且锋面面积比为1:2:2:2的是
,共17种,其中核磁共振氢谱为4组峰,且锋面面积比为1:2:2:2的是![]() 、
、![]() ,故答案为:17;
,故答案为:17;![]() 、
、![]() ;
;
(5)反应Ⅰ的为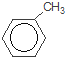 与溴发生取代生成K为
与溴发生取代生成K为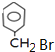 ,反应条件为光照,K在镁、乙醚的条件下生成L为
,反应条件为光照,K在镁、乙醚的条件下生成L为![]() ,故答案为:Cl2,光照;镁、乙醚;
,故答案为:Cl2,光照;镁、乙醚;![]() 。
。


科目:高中化学 来源: 题型:
【题目】有人对某种有机物小分子物质的样品进行分析,发现含有C、H、O、N、P等元素,这种有机小分子物质可能是
A.蛋白质 B.RNA C.麦芽糖 D.脱氧核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R为1~18号元素,其原子所具有的电子层数为最外层电子数的![]() ,它可能形成的
,它可能形成的
含氧酸根离子有:①RO32-,②RO42-,③R2O32-,下列叙述判断正确的是
A. 当它可以形成①时,不可能形成③ B. 当它形成①时,也可以形成②和③
C. 当它可以形成②时,不可能形成③ D. 当它可以形成①时,不可能形成②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.使用填埋法处理未经分类的生活垃圾
B.用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用
C.大量使用薪柴为燃料,践行低碳生活
D.CO2、NO2或SO2的排放是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质。
(1)在实验前,依据Fe2+的 性,填写了下表。
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+ =Fe3++NO2↑+H2O |
依照表中操作,该同学进行实验。观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为红色,则溶液中含有 ;另一只试管滴加几滴 溶液,产生蓝色沉淀,则含有Fe2+。
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的。
提出猜想:
i.NO2与Fe2+发生反应 ⅱ.NO2与Fe3+发生反应
ⅲ.NO与Fe2+发生反应 ⅳ.
(4)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究。

步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。 | 溶液深棕色由 与NO或NO2反应而得到。 |
② | 停止甲中反应,打开活塞k、b、关闭a,持续通入N2一段时间。 | 该操作的目的是 |
③ | 更换新的丙、丁装置,再这一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同。 | 乙瓶中发生的化学方程式为 。 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因,肯定成立的是猜想 ;不确定的是猜想 ,有待后续实验进一步探究。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)上述反应中_________是氧化剂,_________是还原剂,若反应中氧化产物比还原产物多1mol,则转移的电子数目为__________。
(2)装置B的作用是_____________,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________(选“a”“b”或“c”)。
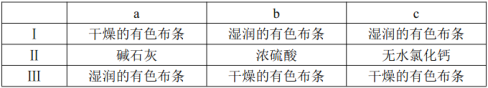
(4)设计装置D、E的目的是为了比较Cl2、Br2、I2的氧化性强弱。已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且I2的苯溶液为紫红色。当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用双线桥法表示出电子转移情况:________________。打开活塞,将D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色。该现象___________(填“能”或“不能”)说明Br2的氧化性大于I2。
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。若烧杯中装有500mL0.2mol/L的NaOH溶液,则最多可吸收标况下的Cl2的体积为____________L(忽略Cl2溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是
A.它与水反应的离子方程式为NH4++H-+H2O=NH3·H2O+H2↑
B.NH5中既有共价键又有离子键
C.NH5的电子式为![]()
D.1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com