
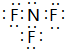 ;
;分析 A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素,D的氢化物形成的酸常用于雕刻玻璃,则D为F元素;A、B元素的最高正价与最低负价的代数和均为零,A为H元素、B为C元素;D的单质具有强氧化性且原子序数大于C而小于F元素,则D是O元素,C元素是植物生长三大营养元素之一,C为N元素;E原子核外K层电子数与M层电子数相等,E为Mg元素;F原子的价电子数等于电子层数的两倍,则F为S元素,则G为Cl元素,
(1)C是N元素、D是F元素,三氟化氮分子中N原子和每个F原子共用一对电子;
(2)元素的非金属性越强,其单质的氧化性越强;
(3)氮化镁和水反应生成氢氧化镁和氨气;
(4)C的氢化物为氨气,与氯气以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,该气体为HCl,由原子守恒确定X化学式.
解答 解:A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素,D的氢化物形成的酸常用于雕刻玻璃,则D为F元素;A、B元素的最高正价与最低负价的代数和均为零,A为H元素、B为C元素;D的单质具有强氧化性且原子序数大于C而小于F元素,则D是O元素,C元素是植物生长三大营养元素之一,C为N元素;E原子核外K层电子数与M层电子数相等,E为Mg元素;F原子的价电子数等于电子层数的两倍,则F为S元素,则G为Cl元素,
(1)NF3分子中N原子与F原子之间形成对共用电子对,其电子式为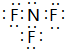 ,
,
故答案为: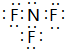 ;
;
(2)元素的非金属性越强,其单质的氧化性越强,氯气能和硫离子反应生成硫单质说明非金属性Cl>S,离子方程式为Cl2+S2-=S↓+2Cl-,故答案为:Cl2+S2-=S↓+2Cl-;
(3)氮化镁和水反应生成氢氧化镁和氨气,反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(4)C的氢化物为氨气,与氯气以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,该气体为HCl,由原子守恒可知X为NCl3,
故答案为:NCl3.
点评 本题考查位置结构性质相互关系及运用,为高频考点,涉及元素推断、电子式的书写、离子方程式和化学方程式的书写等知识点,明确原子结构、元素周期表结构、位置结构及物质性质是解本题关键,注意氮化镁和水反应产物成分,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水应该盛放在棕色的广口瓶中 | |
| B. | 某溶液中加入CCl4后显紫色,证明溶液中有I- | |
| C. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 | |
| D. | 某溶液中滴加BaCl2溶液后有白色沉淀生成,加入稀盐酸后沉淀不消失,则该溶液中可能有Ag+或SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ②、⑧、⑨对应简单离子半径依次减小 | |
| B. | ⑤的三种核素化学性质不同 | |
| C. | 元素=10 ⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F
,F ,AB2
,AB2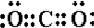 ,A的最简单气态氢化物
,A的最简单气态氢化物 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com