
(12分)(1)二甲醚[CH3OCH3]燃料电池的工作原理如下图一所示.
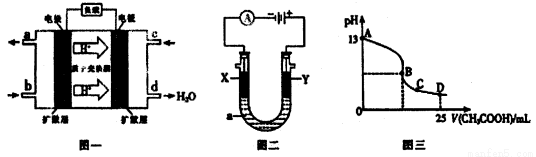
①该电池负极的电极反应式为:_____________________________________。
②电池在放电过程中,b对应的电极周围溶液的pH________。(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连。
①X、Y为石墨,a为2L 0.1mol/LKCl溶液,写出电解总反应的离子方程式:______________。
②X、Y分别为铜、银,a为1L0.2mol/LAgNO3溶液,写出Y电极反应式:____________。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①结合图三计算,上述电解过程中消耗二甲醚的质量为________。(保留两位有效数字)
②若图三的B点pH=7,则滴定终点在_________区间(填“AB”、“BC”,或“CD”)。
③C点溶液中各离子浓度大小关系是__________________。
(1)①CH3OCH3-12e-+3H2O=2CO2+12H+ (2分) ②减小(1分)
(2)①2Cl-+2H2O Cl2↑+H2↑+2OH- (2分) ②Ag - e-=Ag+ (1分)
Cl2↑+H2↑+2OH- (2分) ②Ag - e-=Ag+ (1分)
(3)①0.77g (2分) ②AB (2分) ③c(CH3COO-)>c(K+)>c(H+)>c(OH-)(2分)
【解析】
试题分析:(1)①原电池中负极失去电子,发生氧化反应。则该电池负极是二甲醚发生氧化反应,则电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
②原电池中阳离子向正极移动,根据装置图可知氢离子向右移动,则右端是正极,左端是负极,及电池在放电过程中,b电极周围产生氢离子,则溶液的pH减小。
(2)以上述电池为电源,通过导线与图二电解池相连.
①惰性电极电极KCl溶液的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②X、Y分别为铜、银,a为1L0.2mol/LAgNO3溶液,则相当于是铜上镀银。Y电极与电源的正极相连,作阳极,则Y电极反应式为Ag - e-=Ag+。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加
0.2mol/L,醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①根据图三可知中和之前溶液的pH=13,这说明反应中产生的氢氧根的浓度是0.1mol/L。物质的量的是0.2mol。则根据方程式2Cl-+2H2O Cl2↑+H2↑+2OH-可知转移0.2mol电子,因此根据反应式CH3OCH3-12e-+3H2O=2CO2+12H+可知消耗二甲醚的质量是
Cl2↑+H2↑+2OH-可知转移0.2mol电子,因此根据反应式CH3OCH3-12e-+3H2O=2CO2+12H+可知消耗二甲醚的质量是 。
。
②醋酸和氢氧化钾恰好反应时生成的醋酸钾水解溶液显碱性,因此若图三的B点pH=7,则滴定终点AB之间。
③C点醋酸过量,溶液显酸性,溶质是醋酸和醋酸钾的混合液,则C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-)。
考点:考查电化学原理以及中和滴定曲线应用


科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
元素X和Y在元素周期表中位于相邻的两个周期,X与Y原子核外电子数之和为19,Y原子核内质子数比X多3个,则下列叙述不正确的是
A.X和Y的单质间形成的化合物的化学式可能是Y2X或Y2X2
B.元素X形成的化合物的种类比元素Y形成的化合物种类多
C.Y的单质与硫酸铜溶液反应时有气体放出并有蓝色沉淀生成
D.X和Y在自然界中只能以化合态存在
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.CO2的电子式:
B.Cl-的结构示意图:
C.乙醇的结构式:C2H6O
D.中子数为53、质子数为78的碘原子:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
(14分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是 (用电极反应式解释)溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

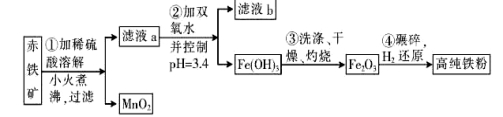
已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时, ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?
(5)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.Na2O2与足量H2O反应,共生成2.24LO2,转移电子的数目为0.2NA
B.1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
C.标准状况下,2.24 L己烷含有分子的数目为0.1NA
D.1mol Na2O和Na2O2固体混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
分子式为C10H12O2的有机物,满足以下两个条件:①苯环上有两个取代基,②能与NaHCO3反应生成气体。则满足条件的该有机物的同分异构体有
A.9 B.10 C.12 D.15
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:填空题
(14分)节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g),△H<0
CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。

①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)= ;平衡时,容器中CO的转化率为 。
②下图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是 。(写出一条)

(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g) CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请在表中的空格处填写“>"“<”或“="。

②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为 mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列物质性质与应用及其对应关系均正确的是
选项 | 性质 | 应用 |
A | 碳酸氢钠可与烧碱反应 | 可用碳酸氢钠作糕点膨松剂 |
B | AgCl难溶于稀硝酸 | 可用稀硝酸和AgNO3溶液检测Cl一 |
C | 浓硫酸具有强氧化性,而稀硫酸的氧化性较弱 | 可用浓硫酸替代稀硫酸与锌反应快速制氢气 |
D | 碳单质性质稳定 | 可在纯铁中加入少量炭增强抗腐蚀性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
与社会、生产、生活、环境等密切相关,下列说法正确的是
A.氟利昂作制冷剂会加剧雾霾天气的形成
B.计算机芯片的材料是二氧化硅
C.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D.利用二氧化碳制造全降解塑料,可以缓解温室效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com