
分析 1.主链含5个C,3号C上有2个乙基;
2.主链含7个C,3、4号C上有1个甲基、且4号C上有1个乙基;
3.主链含11个C,3号C上有1个甲基,6号C上有2个乙基,以此来解答.
解答 解:1.主链含5个C,3号C上有2个乙基,结构简式为CH3CH2C(CH2CH3CH3)2CH2CH3,
故答案为:CH3CH2C(CH2CH3CH3)2CH2CH3;
2.主链含7个C,3、4号C上有1个甲基、且4号C上有1个乙基,结构简式为CH3CH2CH(CH3)C(CH3)(CH2CH3)CH2CH2CH3,
故答案为:CH3CH2CH(CH3)C(CH3)(CH2CH3)CH2CH2CH3;
3.主链含11个C,3号C上有1个甲基,6号C上有2个乙基,结构简式为CH3CH2CH(CH3)CH2CH2C(CH2CH3)2CH2CH2CH2CH2CH3,
故答案为:CH3CH2CH(CH3)CH2CH2C(CH2CH3)2CH2CH2CH2CH2CH3.
点评 本题考查有机物的结构简式,为高频考点,把握主链、支链的判断为解答的关键,侧重分析与应用能力的考查,注意有机物的结构及命名,题目难度不大.


科目:高中化学 来源: 题型:推断题
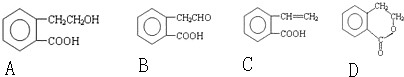
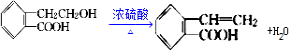 .
.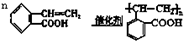 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 洗涤脱排油烟机表面的油脂污物时,热的纯碱溶液比冷的去污效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H++OH-、HCO3-+H2O
H++OH-、HCO3-+H2O +H2CO3+OH-、HCO3-+H2O
+H2CO3+OH-、HCO3-+H2O H3O++CO32-
H3O++CO32- 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com