
| A. | 2:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
分析 所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,根据钠元素及氯元素守恒可知2n(Cl2)=n(Na+)=n(Cl-)+n(ClO-),根据电子转移守恒,计算氯气发生氧化还原反应生成的氯离子的物质的量,溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,计算反应后混合气体中氯化氢的物质的量,根据氢元素守恒计算氢气的物质的量.
解答 解:100mL、3mol/L的NaOH溶液中含有氢氧化钠的物质的量0.1L×3mol/L=0.3mol.
混合气体通入含0.3molNaOH的溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)=0.3mol,所以n(Cl2)=$\frac{1}{2}$×0.3mol=0.15mol.
由于由于溶液中n(ClO-)=0.05mol,所以溶液中n(Cl-)=0.3mol-0.05mol=0.25mol;
令氯气与氢氧化钠反应生成的氯离子的物质的量为xmol,根据电子转移守恒有x=0.05mol,
溶液中Cl-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为0.25mol-0.05mol=0.2mol,
即反应后的混合气体中n(HCl)=0.2molmol,根据氢元素守恒可知,n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.2mol=0.1mol,
所以参加反应的氢气和所用氯气的物质的量之比为0.1mol:0.15mol=2:3.
故选A.
点评 本题考查氧化还原反应的计算,难度中等,判断溶液中n(Na+)=n(Cl-)+n(ClO-)是解题关键.根据NaClO利用方程式计算剩余的氯气,进行解答,比守恒计算更为简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
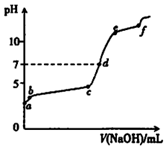 向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )
向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | a点pH<7的原因:Al3++3H2O?Al(OH)3+3H+ | |
| B. | bc段发生的主要反应:Al3++3OH-═Al(OH)3 | |
| C. | ef段发生的主要反应:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | d点,溶液中大量存在的离子是Na+、AlO2-和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 球棍模型: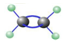 | B. | 分子中六个原子在同一平面上 | ||
| C. | 键角:109o28’ | D. | 碳碳双键中的一根键容易断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 寺院内铜佛像用导线与直流电源的正极连接可以防锈 | |
| B. | 家厨内铁锅洗净后未擦干易生锈主要是发生了化学腐蚀 | |
| C. | 红葡萄酒密封贮存越久越香可能是因为缓慢生成了酯类物质 | |
| D. | 液氯泄漏时,可用肥皂水浸湿的毛巾捂鼻俯卧于低处等待救援 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 漂白粉在空气中久置 | 漂白粉变为块状 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 用坩埚钳夹住点燃的镁条伸入二氧化碳气体中 | 镁条剧烈燃烧 | 二氧化碳作还原剂 |
| C | 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 |
| D | 向浓度均为0.1mol•L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水 | 先有红褐色沉淀生成,后有白色色沉淀生成 | Al(OH)3的溶度积比Fe(OH)3的大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com