
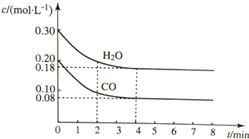
 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
分析 (1)根据υ=$\frac{△c}{△t}$计算反应速率;
(2)①升高温度逆向移动,c(CO)>0.08mol/L,据此判断
②根据5min-6min之间,各物质的浓度变化判断改变的条件.
解答 解:(1)υ=$\frac{△c}{△t}$=$\frac{0.20mol/L-0.08mol/L}{4min}$=0.03mol/(L•min),故答案为:0.03;
(2)①升高温度逆向移动,c(CO)>0.08mol/L,故答案为:>;
②5min-6min之间,CO浓度减小程度与二氧化碳、氢气浓度增大程度相同,水蒸气浓度增大,所以是增大了水蒸气浓度,故答案为:a.
点评 本题考查了反应速率的计算、平衡状态的判断、据数据分析平衡移动的原因,题目比较基础,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 “低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.
“低碳生活”不只是一种理想,更是一种值得期待的新的生活方式.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂属于酯类 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物 | |
| C. | 煤的干馏产物中含有芳香烃 | |
| D. | 质量相等的乙烯和丙烯完全燃烧消耗的氧气的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号);
,五种元素原子半径从大到小的顺序是Na、Si、O、F、H(填元素符号); ,ED4的电子式是
,ED4的电子式是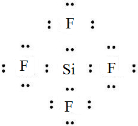 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com