


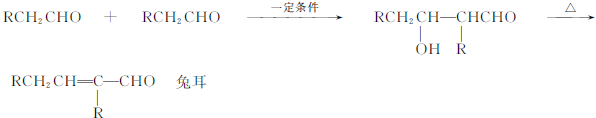
 、E为
、E为 、D为
、D为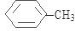 ;根据图示反应①为:
;根据图示反应①为: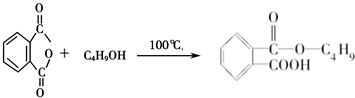 ,则A的结构简式为
,则A的结构简式为 ;反应④为:
;反应④为: +
+
| 浓硫酸 |
| △ |
 +H2O;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
+H2O;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ;B与E(
;B与E( )发生反应生成J(
)发生反应生成J( ),据此进行解答.
),据此进行解答. 、E为
、E为 、D为
、D为 ;根据图示反应①为:
;根据图示反应①为: ,则A的结构简式为
,则A的结构简式为 ;反应④为:
;反应④为: +
+
| 浓硫酸 |
| △ |
 +H2O;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
+H2O;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ;B与E(
;B与E( )反应生成J(
)反应生成J( ),
), ,F中官能团为-OH,羟基的电子式为
,F中官能团为-OH,羟基的电子式为 ,故答案为:
,故答案为: ;
; ;
; +
+
| 浓硫酸 |
| △ |
 +H2O,
+H2O, ;
; +
+
| 浓硫酸 |
| △ |
 +H2O;
+H2O;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、吸热反应在一定条件下也可以发生 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
| D、放热反应在常温下一定很容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(OH-)<C(H+) |
| B、C(HX)>C(x-) |
| C、C(HX)+C(x-)=2C(Na+) |
| D、C(H+)+(Na+)=C(X-)+C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
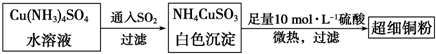
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:
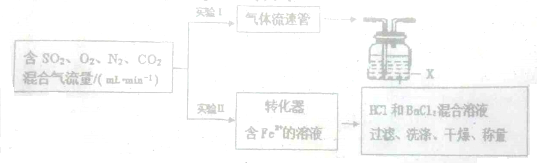
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥ | B、③④⑤⑥ |
| C、②④⑤⑥ | D、①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com