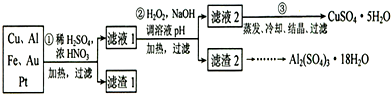
解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu
2+、Al
3+、Fe
2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu
2+、Al
3+、Fe
2+;第①步Cu与酸反应的离子方程式为:Cu+4H
++2NO
3-
Cu
2++2NO
2↑+2H
2O 或3Cu+8H
++2NO
3-
3Cu
2++2NO↑+4H
2O,Au、Pt和酸不反应,所以是滤渣;
故答案为:Cu+4H
++2NO
3-
Cu
2++2NO
2↑+2H
2O 或3Cu+8H
++2NO
3-
3Cu
2++2NO↑+4H
2O,Au、Pt;
(2)第②步加H
2O
2的作用是将Fe
2+氧化为Fe
3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe
2+氧化为Fe
3+,Fe
3+、Al
3+生成沉淀;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
故答案为:加热脱水;
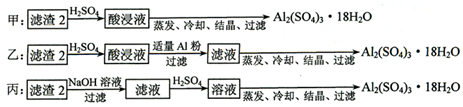
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,
甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H
2SO
4,生成Fe
2(SO
4)
3和Al
2(SO
4)
3,再加Al粉和Fe
2(SO
4)
3生成Al
2(SO
4)
3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)
3反应生成NaAlO
2,再在滤液中加H
2SO
4生成Al
2(SO
4)
3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al
2(SO
4)
3的原子组成没有关系,造成原子浪费,
所以从原子利用率和是否产生杂质考虑知,乙更合理,
故答案为:乙.
分析:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu
2+、Al
3+、Fe
2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu
2+、Al
3+、Fe
2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H
2O
2的作用是把Fe
2+氧化为Fe
3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe
3+和Al
3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断.
点评:本题考查物质的分离、实验设计、试剂选择等知识点,明确离子的性质是解本题关键,题目难度中等.

 Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以是滤渣;
3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以是滤渣; Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O,Au、Pt;
3Cu2++2NO↑+4H2O,Au、Pt;

 阅读快车系列答案
阅读快车系列答案