
 Ca2+(aq)+2OH-(aq),加入以下物质,可使Ca(OH)2减少的是( )
Ca2+(aq)+2OH-(aq),加入以下物质,可使Ca(OH)2减少的是( )| A.NaCl固体 | B.AlCl3溶液 | C.NaOH溶液 | D.CaCl2固体 |
科目:高中化学 来源:不详 题型:单选题
 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 +3
+3
 2
2 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
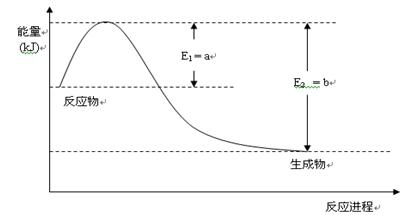
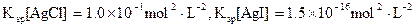 )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
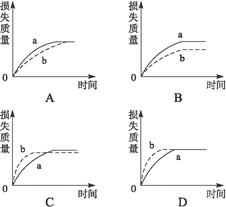
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)+ I2(g)===2HI(g)(正反应是放热反应) |
| B.NH4HCO3===NH3+H2O+CO2(正反应是吸热反应) |
| C.2NO2===N2O4(正反应是放热反应) |
| D.3O2===2O3 (正反应是吸热反应) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室用排水法收集氯气时用饱和食盐水代替水以减少氯气的溶解 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.实验室保存硫酸亚铁溶液时加入几枚铁钉以防止试剂变质 |
| D.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:| A.①③ | B.③④ | C.②③ | D.①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com