
| A、至少存在5种离子 |
| B、Cl-一定存在,且c(Cl?)≥0.4 mol/L |
| C、SO42-、NH4+一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |


科目:高中化学 来源: 题型:
| A、金属Mg与稀硫酸和CO2均能反应,其反应类型相同 |
| B、FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 |
| C、SO2气体通入紫色石蕊试液中,溶液先变红后褪色 |
| D、氢氧化铝、碳酸铵、碳酸氢钠、甘氨酸都既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
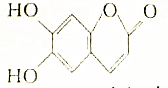 有如图所示的有机物,根据该有机物的结构回答:
有如图所示的有机物,根据该有机物的结构回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | C2H2 | H2 | |
| 燃烧热/kJ/mo | 890.3 | 1299.6 | 285.8 |
| A、-C≡C-的键角为120° |
| B、2H2(g)+O2(g)-2H2O(g)△H=-571.6 kj?mol-l |
| C、C-H键键长小于H-H键 |
| D、2CH4(g)=C2H2(g)+3H2(g)△H=+376.4 kj?mol-l |
查看答案和解析>>
科目:高中化学 来源: 题型:
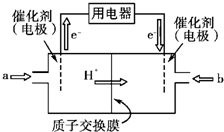 开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示:通入a气体的电极是原电池的
开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示:通入a气体的电极是原电池的查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3:6 |
| B、3:2:1 |
| C、4:3:1 |
| D、6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 4.1×106 | 1.847 | 0.507 | 0.152 |
| A、常温下,大气固氮很难进行,而工业固氮却容易进行 |
| B、模拟大气固氮应用于工业上的意义不大 |
| C、工业固氮时,温度越低时其K越大,所以温度越低反应速率越快 |
| D、大气固氮、工业固氮的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.5 mol/L MgCl2溶液 |
| B、25 mL 0.5mol/L HCl溶液 |
| C、50 mL 1mol/L NaCl溶液 |
| D、200 mL 0.25mol/L CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com