
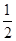 O2(g)=H2O(g) ¦¤H1£½£241.8 kJ”¤mol£1
O2(g)=H2O(g) ¦¤H1£½£241.8 kJ”¤mol£1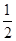 O2(g)=CO(g) ¦¤H2£½£110.5 kJ”¤mol£1
O2(g)=CO(g) ¦¤H2£½£110.5 kJ”¤mol£1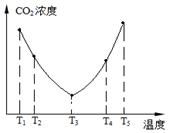
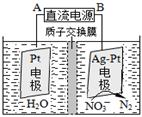
 N2£«2OH££«4H2O
N2£«2OH££«4H2O

 ÅąÓÅČżŗĆÉśĻµĮŠ“š°ø
ÅąÓÅČżŗĆÉśĻµĮŠ“š°ø ÓÅ»Æ×÷ŅµÉĻŗ£æĘ¼¼ĪÄĻ׳ö°ęÉēĻµĮŠ“š°ø
ÓÅ»Æ×÷ŅµÉĻŗ£æĘ¼¼ĪÄĻ׳ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĒāĘųŗĶĀČĘų·“Ӧɜ³ÉĀČ»ÆĒāĘųĢåµÄČČ»Æѧ·½³ĢŹ½ŹĒH2£Øg£©£«Cl2£Øg£©=2HCl£Øg£© |
| B£®ĒāĘųŗĶĀČĘų·“Ӧɜ³É2 molĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ¦¤H£½£«183 kJ”¤mol£1 |
| C£®ĒāĘųŗĶĀČĘų·“Ӧɜ³É2 molĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ¦¤H£½£183 kJ”¤mol£1 |
| D£®ĒāĘųŗĶĀČĘų·“Ӧɜ³É1 molĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ¦¤H£½£«183 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
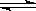 2B(g)ŌŚĒ°110 sÄŚµÄ·“Ó¦½ų³Ģ”£
2B(g)ŌŚĒ°110 sÄŚµÄ·“Ó¦½ų³Ģ”£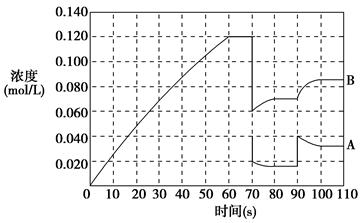
| A£®¼ÓČė“߻ƼĮ | B£®Ą©“óČŻĘ÷Ģå»ż | C£®ÉżøßĪĀ¶Č | D£®Ōö“óAµÄÅØ¶Č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
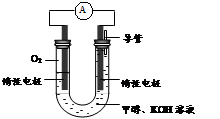
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
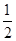 O2(g ) = CO2( g ) ”÷H£½©¤283.0 kJ / mol ”£
O2(g ) = CO2( g ) ”÷H£½©¤283.0 kJ / mol ”£| A£®2:1 | B£®1:2 | C£®1:1 | D£®2:3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 H++CN£µēĄėµÄ¦¤HĪŖ kJ”¤mol£1
H++CN£µēĄėµÄ¦¤HĪŖ kJ”¤mol£1²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®H2O(g)=H2(g)£« O2(g)¦¤H£½242 kJ”¤mol£1 O2(g)¦¤H£½242 kJ”¤mol£1 |
| B£®2H2(g)£«O2(g)=2H2O(l)¦¤H£½£484 kJ”¤mol£1 |
C£®H2(g)£« O2(g)=H2O(g)¦¤H£½242 kJ”¤mol£1 O2(g)=H2O(g)¦¤H£½242 kJ”¤mol£1 |
| D£®2H2(g)£«O2(g)=2H2O(g)¦¤H£½484 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
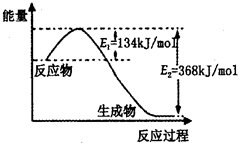
 2NH3£Øg£©”÷H£¼0£¬ĘäĘ½ŗā³£ŹżKÓėĪĀ¶ČTµÄ¹ŲĻµČēĻĀ±ķ£ŗ
2NH3£Øg£©”÷H£¼0£¬ĘäĘ½ŗā³£ŹżKÓėĪĀ¶ČTµÄ¹ŲĻµČēĻĀ±ķ£ŗ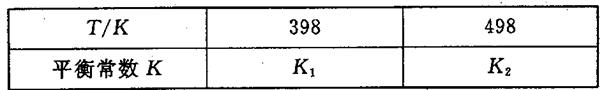
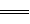 2H2O£Øl£© ”÷H£½£483£®6 kJ£Æmol
2H2O£Øl£© ”÷H£½£483£®6 kJ£Æmol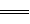 2NO2£Øg£© ”÷H£½£«67£®8 kJ£Æmol
2NO2£Øg£© ”÷H£½£«67£®8 kJ£Æmol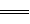 2NH3£Øg£© ”÷H£½£92£®0 kJ£Æmol
2NH3£Øg£© ”÷H£½£92£®0 kJ£Æmol²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
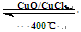 2Cl2(g)+2H2O(g) ¦¤H=" ”Ŗ115.6" kJ/mol
2Cl2(g)+2H2O(g) ¦¤H=" ”Ŗ115.6" kJ/mol 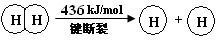

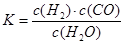 £¬ĖüĖł¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£¬ĖüĖł¶ŌÓ¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ  2NH3(g) ”÷H<0 µÄK=0.5£¬Ōņ400”ꏱ£¬ŌŚ0.5LµÄ·“ӦȯĘ÷ÖŠ½ųŠŠŗĻ³É°±·“Ó¦£¬Ņ»¶ĪŹ±¼äŗ󣬲āµĆN2”¢H2”¢NH3µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol”¢2mol£¬Ōņ“ĖŹ±·“Ó¦v(N2)Õż v(N2)Äę£ØĢī£ŗ£¾”¢£¼”¢£½”¢²»ÄÜČ·¶Ø£©£Ø1·Ö£©
2NH3(g) ”÷H<0 µÄK=0.5£¬Ōņ400”ꏱ£¬ŌŚ0.5LµÄ·“ӦȯĘ÷ÖŠ½ųŠŠŗĻ³É°±·“Ó¦£¬Ņ»¶ĪŹ±¼äŗ󣬲āµĆN2”¢H2”¢NH3µÄĪļÖŹµÄĮæ·Ö±šĪŖ2mol”¢1mol”¢2mol£¬Ōņ“ĖŹ±·“Ó¦v(N2)Õż v(N2)Äę£ØĢī£ŗ£¾”¢£¼”¢£½”¢²»ÄÜČ·¶Ø£©£Ø1·Ö£© 2C(g) + D£Øs£© ¦¤H£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
2C(g) + D£Øs£© ¦¤H£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ| t/K | 300 | 400 | 500 | ” |
| K/(mol”¤L”Ŗ1)2 | 4”Į106 | 8”Į107 | K1 | ” |
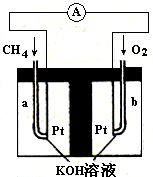
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com