
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) | 224 | 336 | 448 | 448 |
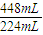 =0.408g,故丙中盐酸与合金恰好反应,
=0.408g,故丙中盐酸与合金恰好反应, 计算氢气的物质的量,故氢原子守恒可知n(HCl)=2n(H2),再根据c=
计算氢气的物质的量,故氢原子守恒可知n(HCl)=2n(H2),再根据c=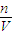 计算;
计算;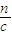 计算需要氢氧化钠溶液的体积.
计算需要氢氧化钠溶液的体积.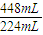 =0.408g,故丙中盐酸与合金恰好反应,
=0.408g,故丙中盐酸与合金恰好反应,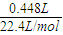 =0.02mol,故氢原子守恒可知n(HCl)=2n(H2)=2×0.02mol=0.04mol,故该盐酸的浓度为
=0.02mol,故氢原子守恒可知n(HCl)=2n(H2)=2×0.02mol=0.04mol,故该盐酸的浓度为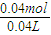 =1mol/L,故答案为:1;
=1mol/L,故答案为:1;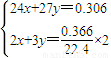
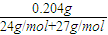 =0.004mol,由Al原子守恒,n(NaAlO2)=n(Al)=0.004mol,由氯离子守恒n(NaCl)=n(HCl)=0.04mol,根据钠离子守恒n(NaOH)=n(NaAlO2)+n(NaCl)=0.004mol+0.04mol=0.044mol,故需要氢氧化钠溶液的体积为
=0.004mol,由Al原子守恒,n(NaAlO2)=n(Al)=0.004mol,由氯离子守恒n(NaCl)=n(HCl)=0.04mol,根据钠离子守恒n(NaOH)=n(NaAlO2)+n(NaCl)=0.004mol+0.04mol=0.044mol,故需要氢氧化钠溶液的体积为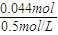 =0.088L=88mL,
=0.088L=88mL,

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
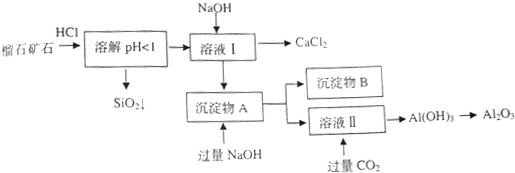
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) |
224 | 336 | 448 | 448 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 | 丁 |
| 合金质量(g) | 0.204 | 0.306 | 0.408 | 0.510 |
| 生成气体体积(mL) (标准状况) | 224 | 336 | 448 | 448 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com