
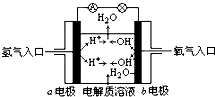
| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;当电解质溶液是氢氧化钾时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子生成氢氧根离子;当电解质溶液是酸时,负极上氢气生成氢离子,正极上氧气和氢离子反应生成水.
解答 解:A.燃料电池中,通入氧气的电极b是正极,所以b电极是正极,故A错误;
B.总反应即氢气燃烧生成水,方程式为:2H2+O2═2H2O,故B正确;
C.氢氧燃料电池中,负极氢气易失电子发生氧化反应,正极氧气易得电子发生还原反应,故C错误;
D.氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,故D正确;
故选AC.
点评 本题考查了燃料电池,要注意的是:虽然燃料相同,但电解质溶液不同时,电极反应式就不同,如氢氧燃料电池,在酸性介质和碱性介质中的电极反应式就不同.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
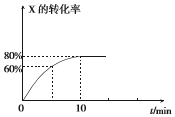 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度等体积的稀硫酸和氢氧化钡溶液反应 | |
| B. | 稀硫酸和过量氢氧化钡溶液反应 | |
| C. | 硫酸氢钠溶液和过量氢氧化钡溶液反应 | |
| D. | 硫酸氢钠溶液和少量氢氧化钡溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com