
有A、B、C、D四种短周期元素在周期表中位置如图所示。
已知:A2+与C原子的电子数相差2。下列推断不正确的是
A.A和D组成的化合物是弱电解质且水溶液呈酸性
B.与A同周期且与C同主族的E元素,其最高价氧化物对应水化物在某些化学反应中常作催化剂。
C.离子半径:C>A>B
D.B与C形成的化合物是冶金工业的一种原料
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表征已达到电离平衡状态的是( )
A.醋酸的浓度达到1 mol·L-1
B.[H+]的浓度达到0.5 mol·L-1
C.[CH3COOH]、[CH3COO-]、[H+]均为0.5 mol·L-1
D.醋酸分子电离成离子的速率和离子重新结合成分子的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO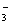 )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
C.0.1 mol·L-1的NH4Cl溶液中:C(Cl-)>C(NH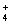 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.c(NH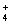 )相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:
)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液、NH4Cl溶液:
c< c<c(NH4HSO4)<c(NH4Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应有广泛应用。
(1)我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为S+2KNO3+3C===K2S+3CO2↑+N2↑。
上述反应中,如1.5 mol还原剂________(填“得到”或“失去”)________ mol电子,则生成________ g还原产物。
(2)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)===2Al2O3(s)
ΔH1=-3 352 kJ·mol-1
Mn(s)+O2(g)===MnO2(s) ΔH2=-521 kJ·mol-1
Al与MnO2反应冶炼金属Mn的热化学方程式是________________。
(3)高温电解技术能高效实现CO2(g)+H2O(g)===CO(g)+H2(g)+O2(g),工作原理示意图如下:
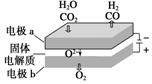
①电极b发生________(填“氧化”或“还原”)反应;
②CO2在电极a放电的反应式是__________________。
(4)黑色沉淀CuS、Cu2S放入浓硫酸中加热一段时间后,沉淀完全溶解,其中CuS溶解的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A为两种固体的混合物,G和I为溶液D的组成成分,E为红褐色沉淀,J为淡黄色固体。反应所加的试剂均足量。
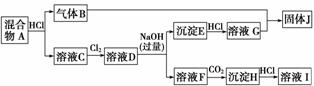
(1)混合物A一定含有的元素为(写元素符号)____________________________________。
(2)溶液F一定含有的阴离子为(写离子符号)______________________________________。
(3)写出B+G→J的化学方程式:_____________________________________________;
写出溶液C→溶液D的离子方程式:____________________________________________。
(4)溶液I中溶质的阳离子常作净水剂,其作用原理是(用离子方程式表示):________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)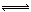 2ClNO(g) ∆H1 < 0 其平衡常数为K1
2ClNO(g) ∆H1 < 0 其平衡常数为K1
b、2NO2(g)+NaCl(s)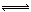 NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)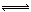 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:
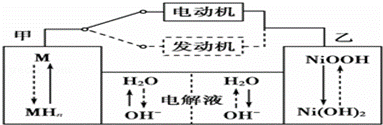
其总反应式为H2+2NiOOH 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上将氨气和空气的混合气体通过铂—铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
A.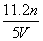 B.
B.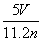
C.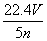 D.
D.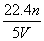
查看答案和解析>>
科目:高中化学 来源: 题型:
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):
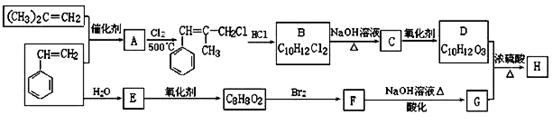 已知:①RCH=CH2 + CH2=CHR′
已知:①RCH=CH2 + CH2=CHR′ CH2=CH2 + RCH=CHR′
CH2=CH2 + RCH=CHR′
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2:  。
。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出生成E的化学方程式: 。
(5)写出H的结构简式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构),其中核磁共振氢谱为5组峰的为 (写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com