
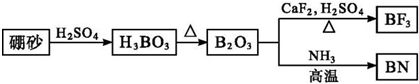
分析 (1)由图及元素守恒可写出这两个反应的方程式:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(2)B的原子序数为5,其基态原子的电子排布式为1s22s22p1;B和N都属于第二周期元素,同周期自左至右元素的电负性逐渐增大,故电负性较大的是N;B属于第ⅢA族元素,化合价为+3价.
(3)依据价层电子对互斥理论,计算出的孤对电子对数以及价层电子对数,可判断出分子的空间构型;
(4)描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,如图所示: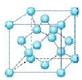 所以金刚石的一个晶胞中含有的碳原子数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 $\frac{25g}{{N}_{A}}$,一个立方氮化硼晶胞的体积是(361.5pm)3,因此立方氮化硼的密度是 $\frac{25×4}{(361.5)^{3}{N}_{A}}$g•pm-3.
所以金刚石的一个晶胞中含有的碳原子数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 $\frac{25g}{{N}_{A}}$,一个立方氮化硼晶胞的体积是(361.5pm)3,因此立方氮化硼的密度是 $\frac{25×4}{(361.5)^{3}{N}_{A}}$g•pm-3.
解答 解:(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为B2O3+3CaF2+3H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3 $\frac{\underline{\;高温\;}}{\;}$2BN+3H2O,
故答案为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(2)基态B原子的电子排布式为1s22s2sp1;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3.故答案为:1s22s2sp1;N;+3;
(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数=$\frac{1}{2}$×(a-xb)=$\frac{1}{2}$×(3-3×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4-中心原子的孤对电子对数=$\frac{1}{2}$×(a-xb)=$\frac{1}{2}$×(4-4×1)=0,其价层电子对数为4,所以其结构为正四面体.故答案为:120°;sp2;正四面体;
(4)根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,因此一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为$\frac{25g}{{N}_{A}}$,一个立方氮化硼晶胞的体积是(361.5pm)3,因此立方氮化硼的密度$\frac{25×4}{(361.5)^{3}{N}_{A}}$是 g•pm-3.
故答案为:4;4;$\frac{25×4}{(361.5)^{3}{N}_{A}}$.
点评 本题考查较为全面,涉及到化学方程式的书写、电子排布式、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ⑤③④⑥ | C. | ⑤②③⑧ | D. | ②③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、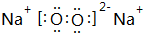 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
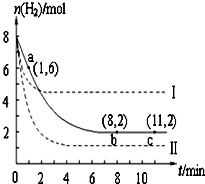 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | T℃时,该反应的化学平衡常数为0.125 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应?△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-、Cl-、Br-、I-的还原性逐渐减弱 | B. | NaOH、KOH、RbOH的碱性逐渐减弱 | ||
| C. | Li、Na、K、Rb、Cs的金属性逐渐减弱 | D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 2NO(g)+2CO(g)=N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H<0 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com