
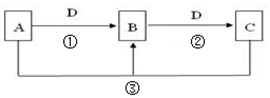
 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系:分析 (1)若D的氯碱工业的主要产品,氯碱工业能产生氯气、氢气和氢氧化钠,B有两性,由转化关系D为NaOH,B为Al(OH)3,C为NaAlO2;
(2)若A是一种碱性气体,常用作制冷剂,为氨气,B是汽车尾气之一,遇空气会变色,则B是NO,D是氧气,C是二氧化氮;
(3)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,则D是Fe,B能和D反应生成C,则A是硝酸、B是硝酸铁、C是硝酸亚铁;
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则C是二氧化硫,A是硫化氢、D是氧气、B是S;
(5)若A、B、C的水溶液均显碱性,焰色反应均为黄色,说明都含有Na元素,D为CO2,A为NaOH、B是碳酸钠、C为碳酸氢钠.
解答 解:(1)若D的氯碱工业的主要产品,氯碱工业能产生氯气、氢气和氢氧化钠,B有两性,由转化关系D为NaOH,B为Al(OH)3,C为NaAlO2,反应②的离子方程式是:Al(OH)3+OH-═[Al(OH)4]-,故答案为:Al(OH)3+OH-═[Al(OH)4]-;
(2)若A是一种碱性气体,常用作制冷剂,为氨气,B是汽车尾气之一,遇空气会变色,则B是NO,D是氧气,C是二氧化氮,反应①的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO2+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO2+6H2O;
(3)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,则D是Fe,B能和D反应生成C,则A是硝酸、B是硝酸铁、C是硝酸亚铁,则B的化学式为Fe(NO3)3,反应②的离子方程式为 2Fe3++Fe═3 Fe2+,
故答案为:Fe(NO3)3; 2Fe3++Fe═3 Fe2+;
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则C是二氧化硫,A是硫化氢、D是氧气、B是S,反应③的化学方程式2H2S+SO2═3S+2H2O,故答案为:2H2S+SO2═3S+2H2O;
(5)若A、B、C的水溶液均显碱性,焰色反应均为黄色,说明都含有Na元素,D为CO2,A为NaOH、B是碳酸钠、C为碳酸氢钠,B为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解离子方程式为CO32-+H2O?HCO3-+OH-,碳酸氢钠溶液呈弱碱性,碳酸氢钠能水解,所以其用途有治疗胃酸过多、发酵粉、泡沫灭火器等,
故答案为:CO32-+H2O?HCO3-+OH-;治疗胃酸过多、发酵粉、泡沫灭火器等.
点评 本题考查无机物推断,为高频考点,明确常见元素化合物性质及物质之间的转化是解本题关键,注意基础知识的积累和归纳,难点是(4)题判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应 | B. | 氧化性 | C. | 还原性 | D. | 不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),是常用的解热镇痛药,实验室合成流程如下:
),是常用的解热镇痛药,实验室合成流程如下:

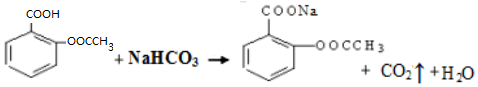 .
.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com