
 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )| A、用“绿色化学”工艺,使原料尽可能转化为所需的物质 |
| B、回收废电池,减少对环境的污染 |
| C、为使农作物高产,大量施用化肥和农药 |
| D、推广垃圾分类存放,分类回收,分类处理 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
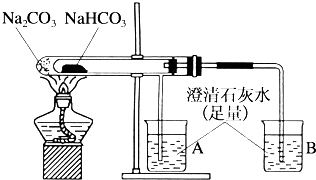 “套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.请观察下列实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.请观察下列实验装置,分析实验原理,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃煤时加入适量石灰石,可减少废气中SO2的量 |
| B、CO2的大量排放能破坏臭氧层,形成“臭氧空洞” |
| C、pH在5.6-7.0之间的降水通常称为酸雨 |
| D、含磷合成洗涤剂易被细菌分解,故不会导致水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
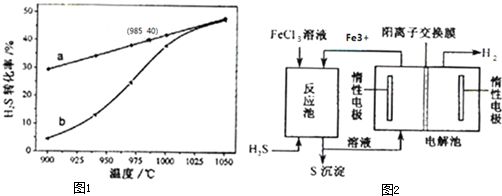
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
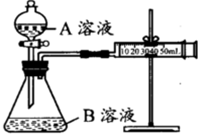 甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4)(10-4mol/(L?min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| 实验步骤及结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
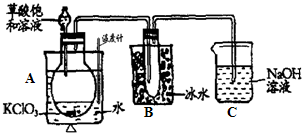
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com