
| A. | 都是白色固体 | B. | 都是强氧化剂 | ||
| C. | 与酸反应的生成物都是盐和水 | D. | 都能与水反应形成强碱溶液 |
分析 Na2O2和Na2O焰色反应为黄色,其中Na2O2具有强氧化性,可与水、二氧化碳反应生成氧气,Na2O为碱性氧化物,与水反应生成NaOH,以此解答该题.
解答 解:A.Na2O是白色物质,Na2O2是淡黄色物质,故A错误;
B.Na2O2中O元素化合价为-1价,在反应中可得到电子,而Na2O不行,所以过氧化钠是强氧化剂,而氧化钠不是,故B错误;
C.Na2O2能和盐酸反应生成氯化钠、水和氧气,氧化钠与酸反应生成盐与水,故C错误;
D.Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,生成NaOH,溶液呈碱性,故D正确.
故选D.
点评 本题考查钠的重要化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握过氧化钠与水、二氧化碳反应的特点,学习中注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 漂白粉解决了氯水漂白时不稳定、难以保存、使用不方便、效果不理想的问题 | |
| C. | 钢铁的腐蚀最普遍的是吸氧腐蚀,最终产物为铁锈 | |
| D. | 温度、压强一定时,放热且熵增的反应能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气参加氧化还原反应时电子转移数一定是2NA | |
| B. | 常温常压下,56 g Fe与足量的盐酸完全反应转移的电子数为3NA | |
| C. | 同温同压下,等质量的H2和O2的体积之比是16:1 | |
| D. | 1mol的Na2O2固体中含有离子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
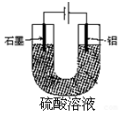 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A. | 阳极电极方程式为Al-3e+6OH-=Al2O3+3H2O | |
| B. | 随着电解的进行,溶液的pH逐渐增大 | |
| C. | 当阴极生成气体3.36L(标况)时,阳极增重2.4g | |
| D. | 电解过程中H+移向Al电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| B. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 氧化剂具有氧化性,还原剂具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 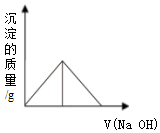 | B. |  | ||
| C. | 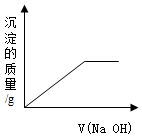 | D. | 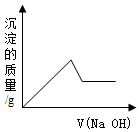 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.75a% | B. | 1.25a% | C. | 1-1.75a% | D. | 1-1.25a% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | MgO的熔点很高,可用于制造耐火材料 | |
| B. | (NH4)2SO4浓溶液能使蛋白质溶液发生盐析,可用于杀菌消毒 | |
| C. | 常温下Al与浓硝酸不反应,可以用铝槽车运输浓硝酸 | |
| D. | 碳具有强还原性,高温下能将二氧化硅还原为硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱可以中和酸性土壤--烧碱显碱性 | |
| B. | 氮气可充入食品包装袋中防腐--氮气化学性质稳定 | |
| C. | 洗涤剂能清洗油污--洗涤剂能溶解油污 | |
| D. | 干冰可用于人工降雨--干冰升华放出热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com