
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量之比为
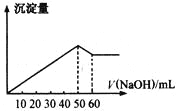
A.6:1B.3:1C.2:1D.1:2
【答案】D
【解析】
根据图像加入0~50mLNaOH溶液时,发生的反应为Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4、MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,50mL时,Al2(SO4)3和MgSO4恰好完全沉淀;加入50~60mLNaOH溶液时,Al(OH)3溶解,发生的反应为Al(OH)3+NaOH=NaAlO2+2H2O,加入60mLNaOH溶液时,氢氧化铝恰好完全溶解,即溶解Al(OH)3消耗了10mLNaOH溶液;所以沉淀Al2(SO4)3消耗30mLNaOH,沉淀MgSO4消耗50mL-30mL=20mLNaOH溶液,根据反应的方程式以及消耗的NaOH物质的量之比等于消耗的NaOH溶液的体积之比,原混合液中Al2(SO4)3与MgSO4的物质的量之比![]() :
:![]() =1:2,答案选D。
=1:2,答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质分离提纯的描述不正确的是

A.分离KCl和MnO2混合物的步骤:加水溶解、过滤,滤渣洗涤后干燥,滤液蒸发结晶
B.蒸馏提纯时温度计的位置如图1所示,收集的产品中混有低沸点杂质
C.NaCl晶体中混有少量KNO3杂质的分离方法为:加水溶解、蒸发结晶、趁热过滤、洗涤、干燥
D.萃取溴水时,加入适量CCl4,转移至分液漏斗中,如图2,用力振摇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有五种物质:①铜线 ②熔化的NaCl ③NaCl晶体 ④氨气 ⑤液态氯化氢,其中能导电的物质是__;属于电解质的是___;属于非电解质的是___。
(2)0.5molH2SO4的质量是__g,能中和___molNaOH,该硫酸所含氢元素的质量与___molNH3中所含氢元素的质量相同。
(3)相同质量的CH4和H2S中分子个数比为___。
(4)在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,n(K+)=0.2mol,n(Mg2+)=0.15mol,n(Cl-)=0.2mol,则n(NO3-)为(_____)
A.0.05mol B.0.20mol C.0.30mol D.0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 次氯酸的电离方程式为HClO===H++ClO-
B. pH=7的溶液一定是中性溶液
C. 在CH3COONa溶液中,c(CH3COO-)<c(Na+)
D. 0.2 mol·L-1CH3COOH溶液中的c(H+)是0.1 mol·L-1 HCl溶液中的c(H+)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向50mL 1mol·L-1的盐酸中加入烧碱,水的KW不变
B. NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用
C. 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D. 常温0.1mol·L-1HA溶液中c(OH-)/ c(H+)=10-8,则0.01mol·L-1 HA溶液中c(H+)=1×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示。则:

(1)写出OA段发生反应的离子方程式:OA段___,图中线段OP:PB=__,
(2)计算原AlCl3溶液的物质的量浓度为__mol/L,
(3)图中A对应的横坐标为__mL,
(4)当加入5mLNaOH溶液时,产生沉淀量为__mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应___(填字母)。
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为___。
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向___(填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___。
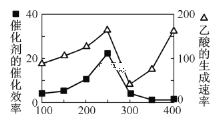
②为了提高该反应中CO2的转化率,可以采取的措施是___。(写一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4= -1048.9kJ·mol-1
(1)上述反应热效应之间的关系式为ΔH4=______。
(2)联氨分子的电子式_____,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为______(已知:N2H4+H+ ![]() N2H5+的K=8.7×107;Kw=1.0×10-14)
N2H5+的K=8.7×107;Kw=1.0×10-14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-=NH3↑+H2O
B. 碳酸氢钙与过量氢氧化钙溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C. 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D. 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com