
【题目】下列离子方程式正确的是
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3=[Ag(NH3)2]+
B.尼泊金酸(![]() )与NaHCO3溶液反应:
)与NaHCO3溶液反应:
![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
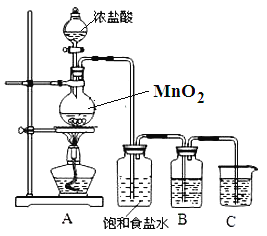
(1)装置B中盛放的试剂是_____(填选项),实验现象为_____,化学反应方程式是_____.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(2)装置C中盛放烧碱稀溶液,目的是_____.
(3)能证明氯元素比硫元素非金属性强的依据为_____. (填序号)
①氯原子比硫原子更容易获得电子形成离子;
②次氯酸的氧化性比稀硫酸强;
③S2﹣比Cl﹣还原性强;
④HCl比H2S稳定.
(4)若B瓶中盛放KI溶液和CCl4试剂,实验后,振荡、静置,会出现的实验现象_____,写出反应的离子方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合右图的反应是
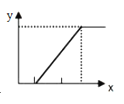
x轴 | y轴 | ||
A | 向氯化铝溶液中加入氢氧化钠溶液 | 氢氧化钠的物质的量 | 生成沉淀的质量 |
B | 向碳酸钠溶液中加入稀盐酸 | 盐酸的体积 | 产生气体的体积 |
C | 向溴化亚铁溶液中通入氯气 | 氯气的体积 | 生成Br2的物质的量 |
D | 向氢氧化钙溶液中通入二氧化碳 | 二氧化碳的体积 | 生成碳酸氢钙的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。请回答下列问题:
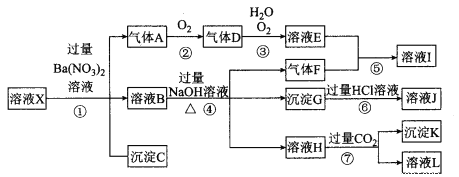
(1)依题意不进行实验即可判断溶液X中一定不存在的离子有 。
(2)下列结论正确的是 (填序号)。
A.X中肯定存在Fe2+、Al3+、NH4+
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀K可能有Al(OH)3
D.溶液X中,一定没有NO3-
(3)产生气体A的离子方程式为 。
(4)转化⑥发生反应的现象为 。
(5)转化③中氧化剂与还原剂的物质的量之比为 。
(6)对不能确定是否存在的离子,如何确定其是否存在? (简述操作过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【改编题】下列实验操作先后顺序正确的是( )
A.先装好药品,再检查装置的气密性
B.先用双手握紧试管,再将导管插入水中检查装置气密性
C.结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管
D.实验装置的组装顺序是从左到右,从上到下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)、高铁酸钠(Na2FeO4,摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)Na2FeO4之所以能净水、杀菌、消毒,原因是 。
(2)已知二氧化氯是一种黄绿色有刺激性气味的有毒气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。用下图所示的装置模拟工业制取及收集ClO2。

①A中反应产物有K2CO3、ClO2等,请写出反应方程式 。
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计,B部分还应补充的装置为 (说明原因)。
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A”“B”或“C”),请画出正确的装置图。
④ClO2需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10ml,稀释成100ml试样;量取V1ml试样加入锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2ml。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
步骤2的目的 (用离子方程式表示)。当 时,可以判断此滴定操作达到终点;由以上数据可以计算原ClO2溶液的浓度为 g/L(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确是
A. 符合分子通式CnH2n+2的烃一定都是烷烃,分子中均只含单键
B. 通过石油裂化可以得到多种气态短链烃,其中包括重要化工原料
C. 苯能使溴水褪色,说明苯环结构中含有碳碳双键
D. 乙醇可以被氧气氧化成乙酸,但乙酸无法再被氧气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式).
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列 .
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 .
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 .
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语回答下列问题:
(1)画出S2﹣的结构示意图: .
(2)写出氨气分子的电子式: .
(3)写出氮气分子的结构式 .
(4)苯酚钠溶液与过量CO2反应的化学方程式 .
(5)CH3CHO与银氨溶液反应的化学方程式: .
(6)CH2=CH﹣COOCH3在一定条件下发生加聚反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com