
| A.上述反应均属于氧化还原反应 | B.该厂可同时建硫酸厂和炼铁厂 |
| C.该厂的原料除富铜矿外,还需空气和硅石 | D.反应④转移12e- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-====Fe(OH)3↓ |
| B.硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-====Fe2S3 |
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++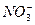 ====4Fe2++3H2O+ ====4Fe2++3H2O+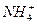 |
| D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+====FeS↓+2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若反应后没有固体存在,则溶液中一定没有Fe3+ |
| B.若反应后有固体存在,则溶液中一定没有Cu2+ |
| C.若反应后溶液中加入KSCN溶液,溶液一定出现红色 |
| D.在反应后溶液中加入氯水,再加入KSCN溶液,溶液一定出现红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、Fe2+ |
| B.Cu2+、Fe2+、Fe3+ |
| C.Cu2+、Fe3+ |
| D.Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeSO4+Ti(SO4)2+3H2O?
FeSO4+Ti(SO4)2+3H2O?| A.防止Fe2+被氧化? |
| B.防止Ti(SO4)2水解 |
| C.减少FeSO4·7H2O的溶解量 ? |
| D.减少Ti(SO4)2的溶解量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com