
����Ŀ����ʮһ�����ѽ���Ϊ������֮��ĵ������������ҵ����������Ϊԭ���Ʊ��������Ѽ��ѵĹ�����������ͼ��ʾ�����������Ҫ�ɷ�Ϊ��������(FeTiO3)������һ������Ԫ���ڷ绯�����л�ת��Ϊ��3�ۣ�FeTiO3�������TiԪ����TiO2+���ڣ�TiOSO4��ˮ��ˮ�⡣
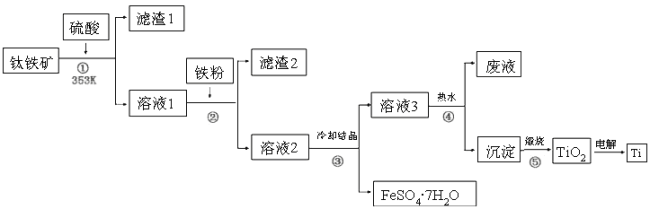
�����������Ϣ�ش��������⣺
��1�����м������۵�Ŀ����__________��
��2�����л��������������________(����ĸ���)��
a���ۡ��е���� b���ܽ��Բ��� c�������ԡ���ԭ�Բ���
��3�������������о���Ҫ���еIJ�����________(���������)��
��4��д���������ӷ���ʽ��_______________���ù�������ˮ�в�����Ŀ����_________
��5���������������еķ�Һ�����̿�(��Ҫ�ɷ�ΪMnO2)��Ӧ������������(MnSO4��������ˮ)���÷�Ӧ�����ӷ���ʽΪ_______________��
��6����ѧ�Ҵӵ��ұ�����Ĺ��յõ�����.�ҳ���ұ���ѵ��¹��ա�
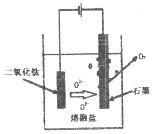
��ֱ�ӵ�����TiO2�������ѣ�ԭ����ͼ��ʾ������������ѵĵ缫��ӦΪ_____________��
�����һ��ʱ�����Ҫ����ʯī�缫��ԭ����_____________��
���𰸡���1����ȥFe3������2��b��3������
��4��TiO2����2H2O![]() H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����5��MnO2��2Fe2����4H��===Mn2����2Fe3����2H2O��6����TiO2+4e-=Ti+2O2-����O2--2e-+C=CO
H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����5��MnO2��2Fe2����4H��===Mn2����2Fe3����2H2O��6����TiO2+4e-=Ti+2O2-����O2--2e-+C=CO
��������
������������̷����������������ܽ�����TiO2+��Fe2+�������������ۻ�ԭFe3+�����˳�ȥ��������������ȴ�ᾧ�����˵õ�FeSO47H2O�ͺ���TiO2+����Һ������������PH��ʹTiO2+ˮ������Ti(OH)4�����˵õ�Ti(OH)4��������Ti(OH)4���ȷֽ����ɻ�����TiO2�������TiO2�õ��ѡ�
��1�����м������۵���ҪĿ���ǽ�Fe3+ת��ΪFe2+����ֹFe2+���������ʴ�Ϊ����ȥFe3����
��2��������У������̷���TiOSO4���ܽ��ԵIJ���ʵ�ֻ����ķ��룬�ѻ�������Һ��ȴ�ᾧ�õ��̷����壬�ʴ�Ϊ��b��
��3�����������������о�Ϊ�����Һ�����IJ����������Ϊ���ˣ��ʴ�Ϊ�����ˣ�
��4�������������ӷ���ʽΪTiO2����2H2O![]() H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ��ʣ�����ù�������ˮ�����У��ʴ�Ϊ��TiO2����2H2O
H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ��ʣ�����ù�������ˮ�����У��ʴ�Ϊ��TiO2����2H2O![]() H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����
H2TiO3��2H��������ˮ�ⷴӦ���ȣ������¶�������ˮ��ƽ��������Ӧ�����ƶ������H2TiO3�IJ�����
��5�����������еķ�Һ����Fe2+����MnO2����������ԭ��Ӧ���������̣��䷴Ӧ�����ӷ���ʽΪ��MnO2+2Fe2++4H+�TMn2++2Fe3++2H2O���ʴ�Ϊ��MnO2+2Fe2++4H+�TMn2++2Fe3++2H2O��
��6�������ʱ�������ϵõ��ӷ�����ԭ��Ӧ�����Զ������ѵõ��������Ѻ������ӣ��͵�Դ�����������缫��ӦʽΪTiO2+4e-=Ti+2O2-���ʴ�Ϊ��TiO2+4e-=Ti+2O2-��
�����һ��ʱ������ɵ���������ʯī�缫��Ӧ����CO��O2--2e-+C=CO����Ҫ��ʱ����ʯī�缫���ʴ�Ϊ��O2--2e-+C=CO��


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]ij��ɫũҩ�ṹ��ʽΪ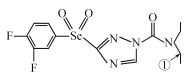 ���ش��������⡣
���ش��������⡣
��1��NԪ�صĻ�̬ԭ�Ӻ�����_____�ֿռ��˶�״̬�ĵ��ӣ���ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ���������ɴ�С˳��������__________________����Ԫ�ط��Żش���ͬ������̬��ԭ�ӵļ۲�����Ų�ʽΪ________________________��
��2�����������ӻ��������Ϊsp2��ԭ����__________�������ڣ������б��Ϊ����̼ԭ�Ӻ�����ɼ����⼸��ԭ�ӹ��ɵĿռ�ṹΪ_____________��
��3��̼���⡢��Ԫ�ؿ��γ�һϵ�еĻ������CH4��C2H6��CH3OH�ȡ��������ʵķе�ߵ�˳��ΪCH4<C2H6<CH3OH����ԭ����_______________________________________���������������ڼ��Է��ӵ�������__________����CH4��Ϊ�ȵ������һ������______��
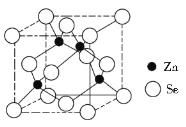
��4������п�ľ����ṹ��ͼ��ʾ����������λ��Ϊ_______���������߳�Ϊd pm���谢���ӵ�������ֵΪNA��������п���ܶ�Ϊ____________�����ػ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�KMnO4�����Ũ���ᷴӦ����������Ϊ��֤±�ص��������Ե����ǿ����ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ���������Ѽ���)

ʵ�������
��.���ɼ�������a���μ�Ũ����
��.��B��C�е���Һ����Ϊ��ɫʱ���н����ɼ�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a
��.����
��1��A�в�������ɫ�����������ʽ��___________________
��2����֤������������ǿ�ڵ��ʵ��������______________
��3��B����Һ������Ӧ�����ӷ���ʽ��______________
��4��Ϊ��֤���������ǿ�ڵ������̢��IJ�����������______________��
��5�����̢�ʵ���Ŀ����______________
��6�������ⵥ�ʵ�������������ԭ����ͬ����Ԫ�ش��ϵ��£����Ӳ����������࣬______________���õ��������������ǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ݻ�Ϊ2L�Ķ����ܱ������У�����3molA��ymolB��������Ӧ��3A(g)+2B(g)![]() 2C(g)+xD(g)��2min��ﵽƽ�⣬��ôӷ�Ӧ��ʼ��ƽ��ʱC������Ϊ0.3mol��L-1��min-1.�����ƶϵĽ�����ȷ����
2C(g)+xD(g)��2min��ﵽƽ�⣬��ôӷ�Ӧ��ʼ��ƽ��ʱC������Ϊ0.3mol��L-1��min-1.�����ƶϵĽ�����ȷ����
A��y![]() 1.2
1.2
B������Ӧ��ϵ��ѹǿ����Ӧ���ʲ�һ������
C��v��(A)��v��(C)��������Ϊƽ��״̬
D�����������ܶȲ��ٱ仯��һ��Ϊƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���н�������֮�����ԭ��ط�Ӧ����ͼ��ʾװ���е缫��Ϊ��Ǧ��(PbS)���缫��Ϊ���з�Ǧ����������е������Һ����ͼ��ʾ����������װ��ʱ��������ָ��ƫת�����缫���������ϼ��٣�a����Һ�м���KSCN��Һδ���ֺ�ɫ������CuSO4��Һδ���ֺ�ɫ�����������й�˵������ȷ����( )

A����ҵ�����ø�ԭ��������
B���缫��������
C����Һ������װ�ú�pH����
D����װ�ø����ĵ缫��ӦΪFeS2��15e��+8H2O=Fe3++2SO42��+16H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƹ㷺����ʳƷ������ʯ�͵ȹ�ҵ�����ϣ�300��400�����ҷֽ⣮
����ʵ������ȡ�ķ���֮һ�ǣ�Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2����
ʵ������ȡʱ������ҵ���������ƺͼ�ȩ���μ��뵽��������Ϊ30-70%�Ĺ���������Һ��(Ͷ�����ʵ���֮������Ϊ1:2:1.2)�����տɵõ���������98%�������ؽ����������͵����ʲ�Ʒ��
��1��������������������Զ࣬��Ŀ����____________��
��2����Ӧ�¶���ÿ�����30-70��֮�䣬�¶Ȳ����ߣ�����Ҫԭ����____________��
��3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ�������Ƶ�Ŀ����____________��
��4��ʵ��ʱ��ǿ������45min����Ŀ����____________���������������Һ��pH7��8����Ŀ����____________����ᾧ���롢����ò�Ʒ��
����ij�о���ѧϰС���ù�ҵ̼���(��Ҫ�ɷ�ΪCaCO3������Ϊ��Al2O3��FeCO3)Ϊԭ�ϣ����Ʊ������Σ������������Һ�����ȡ����ƣ������ͼ�������ʵ��ܽ������������ؽ������������������������pH(��ʼ������pH����������Ũ��Ϊ1.0molL-1����)��
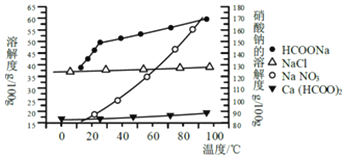
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
�벹��������̼����Ʊ�����Ƶ�ʵ�鷽������ȡ13.6g����������Լ20mLˮ�������Һ���ã�����ȡ��ϸ��̼�����Ʒ10g���ã�____________��
�ṩ���Լ��У�a�������ƣ�B��5molL-1���ᣬC��5molL-1���ᣬD��5molL-1���ᣬe.3%H2O2��Һ��f������ʯ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ�����õ�ʯ��ˮ��Ӧ��ȡ��Ȳ
����Ӧ�Ļ�ѧ����ʽΪ__________��
����ͼ�Ƿ�Ӧװ�ã�������ȷ����__________��

��Ϊ�˼�����Ӧ���ʣ�ͨ����__________����ˮ���÷�Ӧ��__________��Ӧ(�����ȡ����ߡ����ȡ�)
�ܸ÷�Ӧ���������壬��������H2S����������ͭ��Һ���գ���Ӧ�����ӷ���ʽΪ__________��
��2��ʵ����ͨ����Ũ������Ҵ���ϼ�����ȡ��ϩ
�ٻ��Ũ������Ҵ��IJ���������__________��
�ڸ�ʵ������ȡװ�����õIJ��������оƾ��ơ����ܡ�__________��__________��
�۷�Ӧ���ɵ���ϩ�У����ж���CO2��CO2��ˮ�ȶ������ʣ�д��Ũ����ֱ�ӽ��Ҵ���������CO2�Ļ�ѧ����ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µ�ij�ݻ��ɱ���ܱ������н��з�Ӧ��C(s)��H2O(g)![]() CO(g)��H2(g)������˵������۲���������
CO(g)��H2(g)������˵������۲���������
A������ϵ��������ٷ����仯���÷�Ӧ�ѽ���ƽ��
B���ﵽƽ�������ϵ�г�������He��ƽ�ⲻ�ƶ�
C������ˮ�����������������̼�۵�ת����
D��������1 molH-H����ͬʱ����2molH-O������Ӧ�ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ��
��1���������������ڰ�װ��ת�������ɽ�����β������Ҫ��Ⱦ��ת��Ϊ���Ĵ���ѭ�����ʡ�
��֪���� N2(g) + O2(g) ![]() 2NO(g) ��H1��+180.5 kJ��mol-1
2NO(g) ��H1��+180.5 kJ��mol-1
�� C��CO��ȼ���ȣ���H���ֱ�Ϊ-393.5 kJ��mol-1��-283 kJ��mol-1
��2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)����H �� kJ��mol-1
N2(g) + 2CO2(g)����H �� kJ��mol-1
��2����0.20 mol NO��0.10 mol CO����һ���ݻ�Ϊ1L���ܱ������У���Ӧ����������Ũ�ȱ仯��ͼ��ʾ��

��CO��0-9min�ڵ�ƽ����Ӧ����v(CO)=_______________ mol��L��1��min��1 (������λ��Ч���֣�����12 minʱ�ı�ķ�Ӧ��������Ϊ________��
A�������¶� B������NO C���Ӵ��� D�������¶�
���÷�Ӧ�ڵ�24 minʱ�ﵽƽ��״̬��CO2���������Ϊ__________��������λ��Ч���֣�����ѧƽ�ⳣ��K=___________��������λ��Ч���֣���
��3�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c(Na��)= ���ú�����Ũ�ȵĴ���ʽ��ʾ����
��4��ͨ���˹���������ܽ�ˮ��ȼú������CO2ת����HCOOH��O2����֪������0.1 mol��L��1��HCOONa��ҺpH =10����HCOOH�ĵ��볣��![]() =___________________��
=___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com