
【题目】一种固定烟气中CO2的工艺流程如下:
(1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________。
(2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。
a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度
(3) 若测得滤液中c(CO32-)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
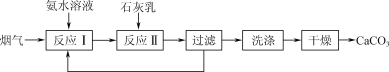
(4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。
(5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。
①除铁时应控制溶液的pH为________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________。
【答案】CO2+2NH3·H2O===2NH![]() +CO
+CO![]() +H2O c 是 初始时快速降低,是由于NH
+H2O c 是 初始时快速降低,是由于NH![]() 、CO
、CO![]() (或HCO
(或HCO![]() )等离子浓度因反应快速降低所致;后来由于氨水的电离及过量Ca(OH)2的电离导致离子浓度增大,导电能力逐渐上升 b Fe(OH)3胶粒小不易过滤;Fe(OH)3胶粒吸附离子带相同电荷相互排斥,导致沉淀速率慢
)等离子浓度因反应快速降低所致;后来由于氨水的电离及过量Ca(OH)2的电离导致离子浓度增大,导电能力逐渐上升 b Fe(OH)3胶粒小不易过滤;Fe(OH)3胶粒吸附离子带相同电荷相互排斥,导致沉淀速率慢
【解析】
该工艺的目的是收集固定烟气中的CO2,先将烟气通入足量的氨水中,通过反应可将其转化为![]() ;再向反应后的溶液中加入石灰乳,石灰乳即Ca(OH)2的悬浊液,因此可再通过反应将
;再向反应后的溶液中加入石灰乳,石灰乳即Ca(OH)2的悬浊液,因此可再通过反应将![]() 转化为CaCO3沉淀,同时也使得氨水再生;将反应后的混合液过滤后,再经过洗涤和干燥即可得到纯度较高的CaCO3。
转化为CaCO3沉淀,同时也使得氨水再生;将反应后的混合液过滤后,再经过洗涤和干燥即可得到纯度较高的CaCO3。
(1)反应Ⅰ中,CO2与过量氨水反应的离子方程式为:![]() ;
;
(2)a.升高温度会降低CO2的溶解,同时也会使氨水挥发,对提高去除率不利,a项不符;
b.加快烟气流速,会使气体与氨水的接触时间缩短,对于吸收CO2不利,b项不符;
c.增大氨水的浓度,可以使得CO2与氨水的反应速率加快,对提高去除率有利,c项符合;
答案选c;
(3)若![]() ,那么溶液中
,那么溶液中 ,Ca2+已经完全沉淀;
,Ca2+已经完全沉淀;
(4)溶液的导电能力与溶液中离子的总浓度以及离子所带的电荷量有关;初始时导电能力快速降低,是由于反应Ⅰ的发生使得![]() 和
和![]() 等离子浓度快速降低所致;后来导电能力又上升,由于反应Ⅰ生成的氨水的电离以及过量的Ca(OH)2电离导致离子的浓度又增加所致;
等离子浓度快速降低所致;后来导电能力又上升,由于反应Ⅰ生成的氨水的电离以及过量的Ca(OH)2电离导致离子的浓度又增加所致;
(5)①由图像可知,pH=2左右,铁的去除率较大,因此除铁时最好将溶液的pH控制在1.5~2.5,b项正确;
②胶体由于分散质粒子直径较小,可以透过滤纸,因此不便过滤;此外,Fe(OH)3胶体颗粒由于带相同的电荷,导致彼此之间相互排斥,难以沉降,这些都对除铁不利。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
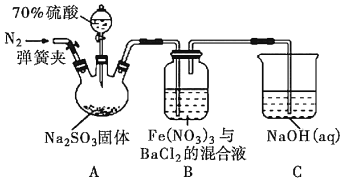
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO![]()
B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Weiss利用光敏剂QD制备2—环已基苯乙烯(c)的过程如图。下列说法不正确的是( )
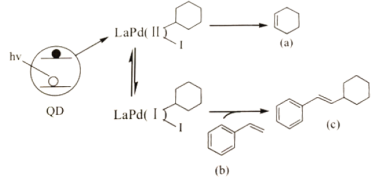
A.a的二氯代物有3种
B.1molb完全燃烧消耗10molO2
C.c具有顺式和反式2种结构
D.a、b、c均能使溴水和稀高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式:
CH3COOH____HClO4_____
Fe(OH)3____Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NH4Cl溶液,在该溶液中各种离子的浓度由大到小顺序为_________。
(2)0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________。
(3)FeCl3溶液,实验室中配制FeCl3溶液时常加入____________以抑制其水解。
(4)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)_____(填“变大”、“ 变小”或“不变”,下同),c(Ag+)__。
②若改加更多的AgI,则c(Ag+)将____。
③若改加Na2S固体,则c(I-)____,c(Ag+)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com