
【题目】常温下,Ksp[Mg(OH)2]=1.1×10-11, Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述不正确的是( )
A. 浓度均为2×10-5mol/L的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀生成
B. 将0.001mol/L的AgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CrO4混合溶液中,先产生AgCl沉淀
C. c(Mg2+)为0.11mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D. 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶液中c(Ag+)减少
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为:8HClO3═3O2↑+2Cl2↑+4HClO4+2H2O.根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是→(填化学式).
②该反应的氧化产物是(填化学式);求所得混合气体的平均相对分子质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸混合溶液200mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6克,向乙中逐渐加入铁粉,产生气体的量随铜粉质量的变化如下图所示(已知:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O)。下列分析结果不正确的是( )
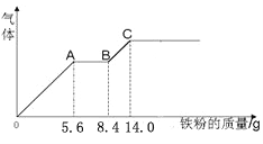
A. 原混合溶液中NO3一的物质的量浓度为4mol/L
B. AB段的反应为:Fe+2Fe3+=3Fe2+
C. C点时,乙中溶质为FeSO4
D. 标准状况下,OA、BC段产生的气体总体积约为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了图1置研究硝酸的性质.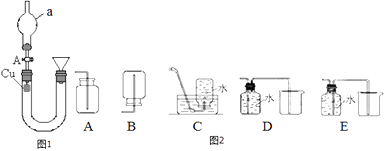
(1)实验一:甲组同学用图一装置来证实稀硝酸与铜反应生成NO.a.装置中a仪器的名称为 .
b.加入硝酸的操作:应先活塞A,然后从右管的漏斗中向U形管中逐渐注入稀硝酸.当注满后,应活塞A,此时观察到的现象 . 待反应一会后若打开活塞A,观察到的现象为 .
c.若要收集NO气体,如图2收集装置中合适的是(填序号) .
d.在100mL混合溶液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L、0.1mol/L向该混合液中加入1.92g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度是 .
(2)实验二:乙组同学利用上述装置完成浓硝酸与铜的反应a.乙组同学发现实验室里有几瓶浓硝酸呈黄色,请用简单的文字和方程式解释这种现象 .
b.同学们发现浓硝酸与铜反应后的溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了NO2气体所致.同学们分别设计了以下3个实验来判断两种看法是否正确.这些方案中可行的是 . (填序号,多选不给分)
①加热该绿色溶液,观察颜色变化
②加水稀释绿色溶液,观察颜色变化
③向该绿色溶液中通入氮气,观察颜色变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA
B.0.1mol/L的 CaCl2溶液中所含Cl﹣数为0.2NA
C.7.8g Na2O2与足量水反应,转移电子数为0.2NA
D.常温常压下,8g CH4含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是
A. Fe2+、Cu2+B. Zn2+、Fe2+C. Cu2+、 H+D. Zn2+ 、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.1mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应aA(g)+bB(g)cC(g)+dD(g),达到平衡时,各物质的物质的量浓度应满足以下关系: ![]() =K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,K=1.
=K,K为一常数,称为化学平衡常数,其反应的K值只与温度有关,现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,K=1.
(1)若升高温度到950℃,达到平衡时K1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和5.0mol H2时,上述平衡向(填“正反应”或“逆反应”)方向移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,请认真观察标签上所列内容后计算:
(1)该溶液的物质的量浓度为molL﹣1 .
(2)该溶液的密度为gmL﹣1(精确到0.1g).
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入g葡萄糖固体(精确到0.1g).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com