

| A、正极反应为:Zn-2e-=Zn2+ |
| B、一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| C、电子从铜片经导线流向锌片 |
| D、电池工作时Zn2+和Cu2+的浓度保持不变 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、五种元素中原子半径最大的是E,最小的是A |
| B、A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物 |
| C、E最高价氧化物对应水化物化学式为H2EO4 |
| D、C的单质在空气中燃烧产物的化学式为C2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO能与SO2反应,CaO可作工业废气的脱硫剂 |
| B、同浓度的Na2CO3溶液在不同温度下的去污能力不同 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①溶液中:c(CO32-)<c(H2CO3) |
| B、溶液的pH:②>① |
| C、溶液中的阴离子种类:②>① |
| D、②溶液中:c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
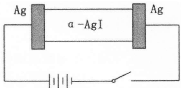 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
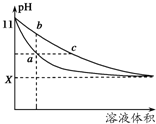 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A、a点导电能力比b点强 |
| B、对于b、c两点,Kb>Kc |
| C、与盐酸完全反应时,消耗盐酸体积Va>Vc |
| D、X的值接近7,但大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com