
| A. | 原子最外层电子数为2的元素一定是金属元素 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性都依次增强 | |
| C. | 金属氧化物就是碱性氧化物 | |
| D. | 化合物XY3中,X可能呈-3价,Y可能呈+1价 |
分析 A.原子最外层电子数为2的元素可以是He;
B.元素非金属性越强,对应氢化物稳定性越弱、还原性越强;
C.金属氧化物可能为两性氧化物,如氧化铝,也可能为酸性氧化物;
D.化合物XY3中,X可能呈-3价,Y可能呈+1价,如NH3.
解答 解:A.原子最外层电子数为2的元素可以是He,不一定是金属元素,故A错误;
B.非金属性F>Cl>Br>I,元素非金属性越强,对应氢化物稳定性越弱、还原性越强,故HF、HCl、HBr、HI的热稳定性依次减弱、还原性都依次增强,故B错误;
C.碱性氧化物一定属于金属氧化物,但金属氧化物可能为两性氧化物,如氧化铝,也可能为酸性氧化物,故C错误;
D.化合物XY3中,X可能呈-3价,Y可能呈+1价,如NH3,故D正确,
故选D.
点评 本题考查原子结构与元素性质、元素周期律应用、碱性氧化物概念等,难度不大,注意利用列举法解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①② | C. | ②④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷(乙炔):通过盛溴水的洗气瓶 | |
| B. | 乙酸乙酯(乙醇):加入乙酸和浓硫酸的混合液,然后加热 | |
| C. | 苯(苯酚):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入生石灰,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
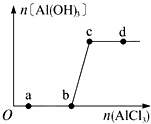 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Fe3+、SO4-、HCO3- | |
| B. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| C. | c点对应的溶液中:Ag+、Ca2+、NO3-、F- | |
| D. | d点对应的溶液中:K+、NH4+、CO32-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com