
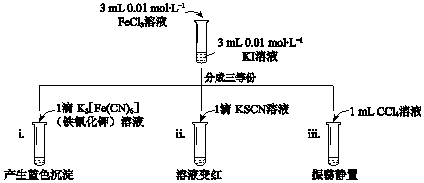
| A. | 实验i中现象说明有Fe2+生成 | |
| B. | 实验ii中现象说明反应后溶液中含有Fe3+ | |
| C. | 实验iii水溶液中c(Fe2+)大于i中c(Fe2+) | |
| D. | 实验iii中再加入4滴0.1 mol•L-1 FeCl2溶液,振荡静置,CCl4层溶液颜色无变化 |
分析 A.Fe2+与铁氰化钾生成蓝色沉淀;
B.Fe3+使KSCN溶液显红色;
C.实验iii中生成的I2萃取到CCl4层,从溶液中分离出产物I2,使反应2Fe3++2I-?2Fe2++I2正向移动,使c(Fe2+)大于i中c(Fe2+);
D.实验iii中再加入4滴0.1 mol•L-1 FeCl2溶液,使反应2Fe3++2I-?2Fe2++I2逆向移动,生成的I2浓度降低,CCl4层溶液颜色变浅.
解答 解:A.Fe2+与铁氰化钾生成蓝色沉淀,实验i中现象说明有Fe2+生成,故A正确;
B.Fe3+使KSCN溶液显红色,实验ii中现象说明反应后溶液中含有Fe3+,故B正确;
C.实验iii中生成的I2萃取到CCl4层,从溶液中分离出产物I2,使反应2Fe3++2I-?2Fe2++I2正向移动,使c(Fe2+)大于i中c(Fe2+),故C正确;
D.实验iii中再加入4滴0.1 mol•L-1 FeCl2溶液,使反应2Fe3++2I-?2Fe2++I2逆向移动,生成的I2浓度降低,CCl4层溶液颜色变浅,故D错误;
故选D.
点评 本题考查了物质的检验与鉴别,注意掌握检验铁离子和亚铁离子的方法,把握可逆反应的特征,试题培养了学生的化学实验能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:| 号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2He中各微粒的最外层电子均达到稳定结构 | |
| B. | 合成Na2He不可能在常温常压下进行 | |
| C. | 定量研究的方法能够促进化学科学的发展 | |
| D. | He与H具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入适量的 AgNO3溶液,有白色沉淀产生,则原溶液中一定有 Cl- | |
| B. | 向某溶液中加入稀盐酸无明显现象,再加 AgNO3溶液有白色沉淀产生,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入 BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸,无明显现象,再加 BaCl2溶液有白色沉淀产生,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2S在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 生成1 mol Cu,转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中加入碳酸钙固体,溶液pH增大 | |
| B. | 锌的金属活动性比铁强,可在海轮外壳上装上锌块以减缓船体腐蚀 | |
| C. | 需加热才能发生的反应一定是吸热反应 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min 后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 常温下,向浓硝酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硝酸反应 |
| C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点;氧化铝>铝 |
| D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com