
| A. | 难溶电解质的溶度积越小,溶解度越大 | |
| B. | 可以通过沉淀反应使杂质离子完全沉淀 | |
| C. | 难溶电解质的溶解平衡是一种动态平衡 | |
| D. | AgCl固体在等浓度的NaCl、CaCl2溶液中的溶解度相同 |
分析 难溶电解质的溶解平衡为动态平衡,达到平衡时,沉淀溶解的速率和析出沉淀的速率相等,一般说明,溶度积越小,溶解度越小,结合离子浓度对平衡移动的影响解答该题.
解答 解:A.难溶电解质的溶度积越小,溶解度越小,故A错误;
B.因没有完全不溶解的难溶电解质,则不能将杂质离子完全除去,一般来说浓度小于10-5mol/L时可认为完全沉淀,故B错误;
C.难溶电解质的溶解平衡为动态平衡,达到平衡时,沉淀溶解的速率和析出沉淀的速率相等,故C正确;
D.氯离子浓度越大,越抑制AgCl的溶解,溶解度越小,故D错误.
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意把握难溶电解质的平衡特点以及影响因素,难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | B. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O | ||
| C. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | D. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
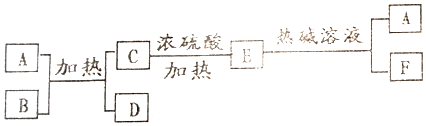
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO(g)═2C(s)+O2(g) | B. | NH4Cl(s)=NH3(g)+HCl(g) | ||
| C. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g) | D. | MgCO3(s)═MgO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
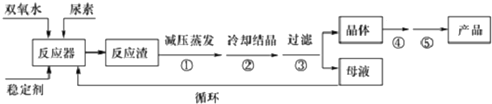
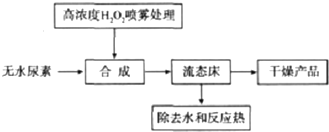
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
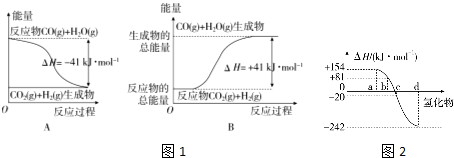
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com