
关于金属铝和铁的说法不正确的是
A.铁与热水不反应,但是高温下可与水蒸气发生置换反应
B.铝箔在空气中受热可以熔化,剧烈燃烧,产生大量的热
C.常温下,可以用铝或铁制容器来盛装冷的浓硫酸或冷的浓硝酸
D.铝元素是地壳中含量最多的金属元素,而铁是用途最广的金属
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:选择题
仅用下表提供的仪器和药品,就能达到相应实验目的是
编号 | 仪器 | 药品 | 实验目的 |
A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分数的NaCl溶液 |
B | 分液漏斗、锥形瓶、试管、 导管及橡皮塞 | 浓硝酸、碳酸钠固体、硅酸钠溶液 | 证明酸性:硝酸>碳酸>硅酸 |
C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
D | 烧杯、分液漏斗、胶头滴管、铁架台 | 混有苯酚杂质的苯、浓溴水 | 提纯混有苯酚杂质的苯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列变化中,不能通过一步反应直接完成的是
A.Al3+→Al(OH)3 B.Al→AlO2-
C.Al2O3 →Al(OH)3 D.Al(OH)3→Al2O3
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高一上学期期末化学试卷(解析版) 题型:选择题
某无色的混合气体可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL该气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则此气体的组成为

A.NH3、NO2、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高一上学期期末化学试卷(解析版) 题型:选择题
只给出下列甲和乙中对应的物理量,不能求出物质的量的是
A.甲:物质中的粒子数;乙:阿伏加德罗常数
B.甲:标准状况时的气体摩尔体积;乙:标准状况时的气体体积
C.甲:固体的体积;乙:固体的密度
D.甲:溶液中溶质的物质的量浓度;乙:溶液体积
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高二上学期期末化学试卷(解析版) 题型:填空题
(共9分)如图所示三套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为_____________________________。
(2)装置2中的铜是______极(填“正”或“负”),该装置中石墨电极所发生的反应为_______________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①甲烧杯中铁为_____极;甲烧杯中石墨电极的电极反应式为____________________
②乙烧杯中电解反应的离子方程式为_________________________________________
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体在标准状况下的体积为________ mL 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高二上学期期末化学试卷(解析版) 题型:选择题
关于下列装置说法正确的是
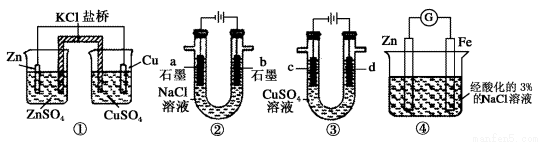
 A.装置①中,盐桥中的Cl-移向ZnSO4 溶液
A.装置①中,盐桥中的Cl-移向ZnSO4 溶液
B.装置②工作一段时间后,b极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省娄底市名校高一上学期期末化学试卷(解析版) 题型:填空题
(8分)某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则:
(1)最先检出的离子是 ,需加入稍过量的试剂是 (写化学式);
(2)最后检出的离子是 ,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省娄底市名校高二上学期期末化学(理)试卷(解析版) 题型:填空题
(10分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) 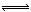 CH3OH(g)。
CH3OH(g)。
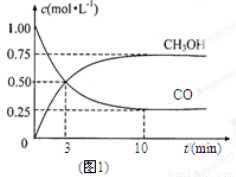

(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= ; H2的平衡转化率为_________________________。
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式 。
(3)该温度下,反应平衡常数K=______(填数值)。
(4)恒容条件下,下列措施中能使反应体系中 增大的措施有 。
增大的措施有 。
A.升高温度 B.充入He气
C.再充入2 molH2 D.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com