分析:(1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子,阴极上是氢离子得电子;
(2)根据电解精炼铜的工作原理知识来回答;
(3)若a为CuSO
4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电;Y电极上氢氧根离子放电;通过一段时间后,向所得溶液中加入0.2molCu(OH)
2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH
2O,根据氧气和转移电子之间的关系式计算;
(4)若电解含有0.04molCuSO
4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,则生成n(Cl
2)=
n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=
=0.03mol>0.02mol,在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl
2)+4n(O
2)=0.04mol+0.04mol=0.08mol,阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,所以阴极上氢离子不放电,根据生成氧气的量计算c(H
+).
解答:
解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H
++2e
-=H
2↑,
故答案为:2H
++2e
-=H
2↑;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl
--2e
-=Cl
2↑,
故答案为:2Cl
--2e
-=Cl
2↑;
③阳极上是氯离子离子失电子,阴极上是氢离子得电子,电解总反应离子方程式为:2Cl
-+2H
2O═2H
2+Cl
2↑+2OH
-,故答案为:2Cl
-+2H
2O═2H
2+Cl
2↑+2OH
-;
(2)①电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu
2++2e
-=Cu,故答案为:纯铜;Cu
2++2e
-=Cu;
②电解方法精炼粗铜,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e
-=Cu
2+,故答案为:粗铜;Cu-2e
-=Cu
2+;
(3)若a为CuSO
4溶液,则X电极上铜离子放电,当铜离子放电完全后,氢离子再放电,Y电极上氢氧根离子放电,所以电池反应式有2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4、2H
2O
O
2↑+2H
2↑;通过一段时间后,向所得溶液中加入0.2molCu(OH)
2粉末能使溶液恢复原状,相当于加入0.2molCuO、0.2molH
2O,所以阴极上析出氢气、Cu,根据原子守恒得n(H
2)=n(H
2O)=0.2mol,n(CuO)=n(Cu)=0.2mol,
设生成0.2molCu转移电子的物质的量为x、生成0.2mol氢气转移电子的物质的量为y,
2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4转移电子
2mol 4mol
0.2mol x
2mol:4mol=0.2mol:x
x=
=0.4mol
2H
2O
O
2↑+2H
2↑ 转移电子
2mol 4mol
0.2mol y
2mol:4mol=0.2mol:y
y=
=0.4mol,
所以转移电子的物质的量=xmol+ymol=0.4mol+0.4mol=0.8mol;
故答案为:2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4、2H
2O
O
2↑+2H
2↑;0.8mol;
(4)若电解含有0.04molCuSO
4和0.04molNaCl的混合溶液400ml,阳极上先氯离子放电后氢氧根离子放电,假设阳极上氯离子完全放电,
则生成n(Cl
2)=
n(NaCl)=0.02mol,当阳极产生的气体672mL(标准状况下)时,生成气体的物质的量=
=0.03mol>0.02mol,
在阳极上还有氧气生成,生成氧气的物质的量为0.01mol,阳极上转移电子的物质的量=2n(Cl
2)+4n(O
2)=0.04mol+0.04mol=0.08mol,
阴极上铜离子完全放电时转移电子的物质的量=2×0.04mol=0.08mol,
所以阴极上氢离子不放电,当阳极上生成氧气时,同时阳极附近有氢离子生成,电池反应式为2Cu
2++2H
2O
2Cu+O
2↑+4H
+,
根据氧气和氢离子的关系式得n(H
+)=4n(O
2)=0.04mol,
则C(H
+)=
=0.1mol/L,
故答案为:0.1mol/L.

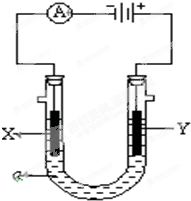 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:



 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题: ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有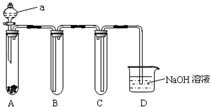 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置. (提示:在酸性条件下MnO4-被还原为Mn2+)
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置. (提示:在酸性条件下MnO4-被还原为Mn2+)